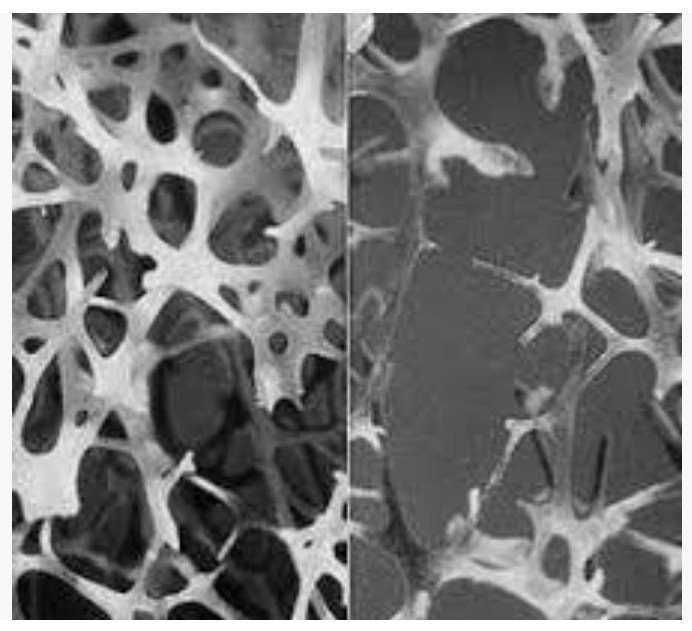
Остеопороз – это заболевание, которое характеризуется слабыми и хрупкими костями, часто приводит к тяжелым переломам костей, другим травмам. Миллионы людей во всем мире имеют диагноз остеопороза.
Кости являются динамическими органами, которые постоянно подвергаются резорбции и обновлению. Когда резорбция преобладает над обновлением, снижается плотность костной ткани.
Медицинские исследователи заинтересованы в обнаружении способов не только для приостановления резорбции костной ткани, но и для генерации нового материала. Идеальное лечение должно омолодить рост, чтобы она возвратилась к первоначальным уровням своей плотности.
Одной перспективной областью для достижения этой цели является клеточная терапия.
Совместное исследование Ванкью Чена, Дэвида Дж. Бэйлинка, ДжастинаБриер-Джонса, Аманды Нейсес, Джейсона Б. Кирояна, Чарльза Х. Рандла, Кин-Хин Уильяма Лау и Сяо-Бинг Чжана из Университета Лома Линда и Мемориального медицинского центра Джерри Л.
Петтиса построено на их предыдущей работе с генетически модифицированными гемопоэтическими стволовыми клетками по определению и оптимизации фактора роста, который вызывает увеличение на 45% прочности у мышиных моделей.
Их работа опубликована в Proceedings of the National Academy of Sciences.
В попытке обнаружить генную терапию, которая способствует росту костей, с минимальными побочными эффектами, группа доктора Чжана сосредоточилась на PGDFB (platelet-derived growth factor, subunit B – тромбоцитарный фактор роста, субъединица B), так как некоторые его свойств делают этот фактор заманчивым кандидатом.
Кроме того, PGDFB уже одобрен FDA для лечения костных дефектов челюсти и рта.
Их изучение PGDFB состояло сперва в выделении гемопоэтических стволовых клеток от мыши-донора. Гемопоэтическим стволовым клеткам отдают предпочтение, в сравнении с другими стволовыми клетками, так как они размещаются в одной из основных областей потери костной ткани – на эндостальной поверхности кости.
Затем выделенные гемопоэтические стволовые клетки генетически модифицируются для сверхэкспрессииPGDFB.
Мышь-реципиента облучают перед введением модифицированных гемопоэтических стволовых клеток. Стадия облучения, хотя и необходимая для подготовки мышей, может быть препятствием для клинического применения, но авторы надеются, что будущие исследования смогут устранить ее.
В настоящее время, задачей этого эксперимента было изучить, как мышь-реципиент ответит на введение PGDFB.
Через 4 недели была проверена бедренная. Хотя доктор Чен обнаружил, что PGDFB способствовал новому образованию губчастой, на высоких уровнях этот фактор также негативно влиял на минеральную плотность.
Чтобы преодолеть это влияние, ученые изучили более слабые промоутеры для оптимизации дозирования экспрессии PGDFB в гемопоэтических стволовых клетках.
Исследователи обнаружили, что промоутер фосфоглицераткиназы хорошо работал для уменьшения количества PGDFB, экспрессированного в клетках. Они наблюдали увеличение объема губчатой кости, ее толщины и количества, а также увеличение плотности соединений.
Кроме того, объем компактной костной ткан увеличивался на 20-30%, тогда как пористость компактной ткани снизилась на 40%. Важно отметить, что более низкое дозирование PGDFB привело к тому, что не наблюдалось снижения минеральной плотности кости в связи с остеомаляцией или гиперпаратиреозом.
Бедренная кость леченной мыши и контрольный образец прошли трехточечное механическое испытание для проверки целостности новой кости.
Бедренная кость мыши, леченной при помощи промоутера фосфоглицераткиназы и PGDFB, продемонстрировала увеличение максимальной нагрузки на 45% и увеличение жесткости на 46%, что указывает на формирование качественной костной ткани.
Следующим шагом было выяснить, почему работает это сочетание промоутера фосфоглицераткиназы и PGDFB. Предыдущие исследования группы доктора Чжана обнаружили, что только FGF2 (фактор роста фибробластов), основываясь на настоящем исследовании, PGDFB являются эффективными генетическими факторами для способствования образованию костной ткани.
После проведения испытаний для изучения этого механизма, ученые обнаружили доказательства, что PGDFB содействует образованию мезенхимальных стволовых клеток костного мозга и ангиогенезу – двум важным факторам роста.
Исследователи также выявили, что оптимизация дозирования PDGFB была важной для содействия образованию остеобластов.
Наконец, доктор Чэнь и его коллеги изучили, как PDGFB с промоутером фосфоглицераткиназывлияют на остеокластогенез (или создание клеток, которые поглощают кость). Как выяснилось, бедренные кости леченных мышей также имели увеличение биомаркеров остеокластов.
Это увеличение остеобластов и остеокластов указывает на то, что костная ткань леченных мышей подвергается восстановлению и ремоделированию.
В целом, это исследование предлагает убедительные патологические механизмы для создания будущих методов клеточной терапии для лечения остеопороза.
Мышиные модели продемонстрировали быстродействующую методику, которая приводит к образованию костной ткани и увеличению прочности костей.
Дорогие друзья. Данный материал не является медицинским советом, за диагнозом и способом лечения, обратитесь к специалисту для консультации.