СИАЛИС (тадалафил) – это селективный ингибитор специфической фосфодиэстеразы типа 5 (ФДЭ5) циклического гуанозинмонофосфата (цГМФ). таблетки покрытые пленочной оболочкой инструкция

Имеет эмпирическую формулу C22H19N3O4 и молекулярный вес 389,14.
Структурная формула:
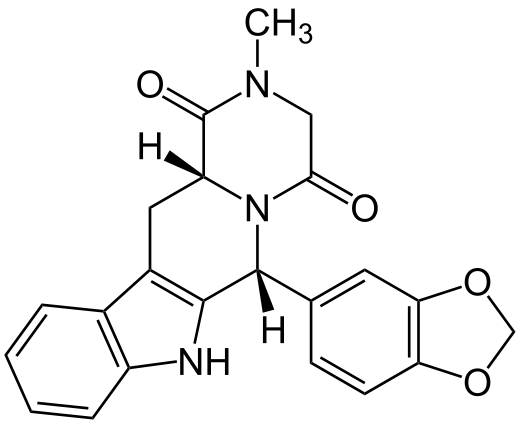 Химическое название — (6R,12aR)-6-(1,3-Бензодиоксол-5-ил)-2-метил-2,3,6,7,12,12a-гексагидро-2-метилпиразино[1′,2′:1,6]пиридо[3,4-b]индол-1,4-дион (в виде гидрохлорида).
Химическое название — (6R,12aR)-6-(1,3-Бензодиоксол-5-ил)-2-метил-2,3,6,7,12,12a-гексагидро-2-метилпиразино[1′,2′:1,6]пиридо[3,4-b]индол-1,4-дион (в виде гидрохлорида).
Это кристаллическое твердое вещество, которое практически нерастворимо в воде, очень мало растворимо в этаноле.
Таблетки покрытые пленочной оболочкой миндалевидной формы для перорального применения.
Каждая содержит 2,5, 5, 10 или 20 мг тадалафила и следующих неактивных ингредиентов:
- моногидрат лактозы,
- натриевая соль кроскармелозы,
- гидроксипропил целлюлоза,
- микрокристалическая целлюлоза,
- натрия лаурилсульфат,
- магния стеарат,
- гипромеллоза,
- триацетин,
- титана диоксид,
- оксид железа,
- тальк.
Для ознакомления так же рекомендуем посмотреть рейтинг препаратов для потенции
ПОКАЗАНИЯ И ПРИМЕНЕНИЕ
1.1 Эректильная дисфункция
Показан для лечения эректильной дисфункции (ЭД).
1.2 Доброкачественная гиперплазия предстательной железы
Показан для лечения признаков и симптомов доброкачественной гиперплазии предстательной железы (ДГПЖ).
1.3 Эректильная дисфункция и доброкачественная гиперплазия предстательной железы
Показан для лечения эректильной дисфункции и признаков и симптомов доброкачественной гиперплазии предстательной железы (ЭД/ДГПЖ).
1.4 Ограничение применения
Если применяется в комбинации с финастеридом в качестве начальной терапии ДГПЖЗ, такое использование рекомендуется не дольше 26 недель, поскольку его полезные свойства уменьшаются с 4 до 26 недель, а преимущества после 26 недель неизвестны.
ФОРМА ВЫПУСКА
Производится в виде миндалевидных таблеток различного размера и различного оттенка желтого цвета, в зависимости от дозы:
- Таблетки 2,5 мг с надписью «C 2 1/2»
- Таблетки 5 мг с надписью «C 5»
- Таблетки 10 мг с надписью «C 10»
- Таблетки 20 мг с надписью «C 20»
Противопоказания
4.1 Нитраты
У тех, кто принимает органические нитраты в любом виде, регулярно или эпизодически, противопоказано. В исследованиях клинической фармакологии СИАЛИС продемонстрировал способность потенцировать гипотензивные эффекты нитратов (см. раздел Клиническая фармакология (12.2)).
4.2 Реакции гиперчувствительности
Противопоказан у пациентов с известными тяжелыми реакциями гиперчувствительности на тадалафил (СИАЛИС или АДЦИРКА). Были сообщения о развитии реакций гиперчувствительности, включая синдром Стивена-Джонсона и эксфолиативный дерматит (см. раздел Побочные реакции (6.2)).
4.3 Одновременное использование со стимуляторами гуанилатциклазы (ГЦ)
Не назначайте его, принимающим стимуляторы ГЦЮ, такие как риоцигуат. Ингибиторы ФДЭ5, могут усиливать гипотензивные эффекты стимуляторов ГЦ.
5 ПРЕДУПРЕЖДЕНИЯ И МЕРЫ ПРЕДОСТОРОЖНОСТИ
Ведение эректильной дисфункции и ДГПЖ должно включать соответствующее медицинское обследование для выявления их потенциальных причин, а также вариантов лечения.
Перед назначением важно учитывать следующие особенности:
5.1 Сердечно-сосудистая система
Врачи должны учитывать состояние сердечно-сосудистой системы, так как существует риск для сердца, связанный с сексуальной активностью. Таким образом, лечение эректильной дисфункции, не должно применяться у мужчин, которым не рекомендуется сексуальная активность в связи с общим состоянием сердечно-сосудистой системы.
Тем кто испытывает симптомы до начала сексуальной активности, нужно рекомендовать воздержаться от дальнейшей сексуальной активности и немедленно обратиться за медицинской помощью.
Врачи должны обсудить с пациентами необходимые действия в случаях, когда у них появились стенокардитические боли в грудной клетке, требующие введения нитратов после приема лекарства.
У того кто принял сиалис, когда введение нитратов считается необходимым с медицинской точки зрения, для лечения опасных для жизни ситуаций, перед введением нитратов должно пройти не менее 48 часов от последней дозы.
В таких обстоятельствах нитраты все еще должны вводиться под пристальным медицинским наблюдением с соответствующим мониторингом гемодинамики. Таким образом, испытывающие стенокардитическую боль в грудной клетке после приема средства должны немедленно обратиться за медицинской помощью (см. разделы Противопоказания (4.1) и Информация для консультирования пациентов (17.1)).
Люди с обструкцией выносящего тракта левого желудочка (например, аортальный стеноз и идиопатический гипертрофический сибаортальный стеноз) могут иметь повышенную чувствительность к действию вазодилататоров, включая ингибиторы ФДЭ5.
В клинические исследования эффективности и безопасности средства не были включены следующие группы пациентов с сердечно-сосудистыми заболеваниями:
- Инфаркт миокарда в течении последних 90 дней.
- Нестабильная стенокардия или стенокардия, развивающаяся во время полового акта.
- 2 класс сердечной недостаточности или выше (по классификации Нью-Йоркской кардиологической ассоциации, NYHA) в последние 6 месяцев.
- Неконтролированные аритмии, гипотензия (<90/50 мм рт. ст.) или неконтролируемая гипертензия.
- Инсульт в течение последних 6 месяцев.
Таким образом, до получения дополнительной информации, препарат не рекомендуется применять у пац. из этих групп.
Как и другие ингибиторы ФДЭ5, обладает умеренными системными сосудорасширяющими свойствами, которые могут привести к транзиторному снижению артериального давления.
В клинико-фармакологическом исследовании тадалафил 20 мг приводил к среднему максимальному снижению артериального давления в положении лежа на спине, по сравнению с плацебо, на 1,6 / 0,8 мм рт. ст. (см. раздел Клиническая фармакология (12.2)).
Хотя этот эффект не должен иметь никаких последствий у большинства пациентов, врачи, перед назначением СИАЛИСА, должны тщательно обдумать, не появятся ли у их пац.с существующими сердечно-сосудистыми заболеваниями негативные последствия в результате этих сосудорасширяющих свойств. Пациенты с сильно нарушенным вегетативным контролем над артериальным давлением могут быть особенно чувствительны к действию вазодилататором, включая ингибиторы ФДЭ.
5.2 Возможность взаимодействия с другими лекарствами при ежедневном приеме
Врачи должны знать, что ежедневный прием обеспечивает постоянные уровни тадалафила в плазме, что нужно учитывать при оценке возможности взаимодействия с другими (например, с нитратами, альфа-блокаторами, антигипертензивными средствами, сильными ингибиторами CYP3A4) и существенным употреблением алкоголя (см. раздел Взаимодействие с другими лекарствами (7.1, 7.2, 7.3)).
5.3 Длительная эрекция
Были редкие сообщения о длительности эрекции дольше 4 часов и приапизме (болезненная эрекция длительностью более 6 часов) при применении препаратов из этой группы. Без срочного лечения приапизм может привести к необратимому повреждению эректильной ткани. Пац. с эрекцией длительностью более 4 часов, независимо от того, болезненная она или нет, должны немедленно обратиться за медицинской помощью.
CИАЛИС нужно с осторожность применять у пациентов, которые имеют заболевания, могущие предрасполагать их к приапизму (например, серповидноклеточная анемия, множественная миелома или лейкемия), или у пац. с анатомической деформацией полового члена (например, угловатость, кавернозный фиброз или болезнь Пейрони).
5.4 Влияние на глаза
Врачи должны советовать пациентам прекратить прием всех ингибиторов ФДЭ5, и обращаться за медицинской помощью в случае внезапной потери зрения в одном или двух глазах. Такое событие может быть признаком неартериитической передней ишемической невропатии зрительного нерва (НПИНЗН)– редкого заболевания, вызывающего ухудшение зрения, включая его постоянную полную потерю, о котором были постмаркетинговые сообщения во временной ассоциации с употреблением всех ингибиторов ФДЭ5.
На основании опубликованных литературных данных, ежегодная распространенность НПИНЗН составляет 2,5-11,8 случаев на 100 000 мужчин в возрасте ?50 лет. Существование связи недавнего применения ингибиторов ФДЭ5 с острым началом НПИНЗН было оценено в наблюдательном исследовании.
Результаты свидетельствуют о примерно двукратном росте риска НПИНЗН в течение 5 периодов полувыведения ингибитора ФДЭ5 после его приема. Исходя из этой информации, невозможно определить, связаны ли эти случаи напрямую с использованием ингибиторов ФДЭ5 или с другими факторами (см. раздел Побочные реакции (6.2)).
Врачи должны учитывать возможность негативного влияния ингибиторов ФДЭ5 у пациентов с существующими факторами риска НПИНЗН. Лица, уже перенесшие НПИНЗН, имеют повышенный риск рецидива этого заболевания. Таким образом, ингибиторы ФДЭ5, нужно применять у этих пац. с осторожностью, и только тогда, когда ожидаемая польза перевешивает возможные риски.
Люди с «застойным» диском зрительного нерва также имеют повышенный риск НПИНЗН, по сравнению с остальным населением; тем не менее, доказательств для проведения скрининга этого редкого заболевания у предполагаемых пользователей ингибиторов ФДЭ5, недостаточно.
Пациенты с наследственными дегенеративными заболеваниями сетчатки, включая пигментный ретинит, не были включены в клинические исследования, поэтому применение у них не рекомендуется.
5.5 Внезапная потеря слуха
Врачи должны советовать пациентам прекратить прием всех ингибиторов ФДЭ5, и обращаться за медицинской помощью в случае внезапного ухудшения или потери слуха. Об этих событиях, которые могут сопровождаться звоном в ушах и головокружением, сообщалось во временной связи с приемом ингибиторов ФДЭ5. Невозможно определить, связаны ли эти случаи напрямую с ингибиторами ФДЭ5 или с другими факторами (см. раздел Побочные реакции (6.1, 6.2)).
5.6 Альфа-блокаторы и антигипертензивные лекарства
Врачи должны обсудить с пациентами способность препарата усиливать гипотензивные эффекты альфа-блокаторов и антигипертензивных средств (см. раздел Взаимодействие с другими лекарствами (7.1) и Клиническая фармакология (12.2)).
Следует с осторожностью назначать ингибиторы ФДЭ5 с альфа-блокаторами. Ингибиторы ФДЭ5, и альфа-адреноблокаторы являются вазодилататорами, снижающими артериальное давление. Когда вазодилататоры используются в комбинации, можно ожидать их взаимоусиливающего влияния на артериальное давление.
У некоторых пациентов, одновременное использование лекарств из двух этих групп, может значительно снизить артериальное давление (см. раздел Взаимодействие с другими лекарствами (7.1) и Клиническая фармакология (12.2))., что может привести к симптоматической гипотензии (например, обмороки). Нужно принимать во внимание следующие факторы:
Эректильная дисфункция
- Пациенты должны быть стабильными при лечении альфа-блокаторами перед началом применения ингибиторов ФДЭ. Пацииент, демонстрирующие гемодинамическую нестабильность при лечении альфа-блокаторами, имеют повышенный риск симптоматической гипотензии при одновременном использовании ингибиторов ФДЭ5.
- У пациентов., имеющих стабильное состояние при лечении альфа-блокаторами, употребление ингибиторов ФДЭ5 должна быть начато с самой низкой рекомендованной дозы.
- У пациентов., уже принимающих оптимизированную дозу ингибиторов ФДЭ5, лечение альфа-блокаторами должно начинаться с наиболее низкой дозы. Пошаговое повышение дозы альфа-блокатороа может быть связано с дальнейшим снижением артериального давления при условии приема ингибиторов ФДЭ5.
- На безопасность комбинированного использования ингибиторов ФДЭ5 и альфа-блокаторов могут влиять и другие факторы, включая снижение объема циркулирующей крови и использование других антигипертензивных средств. (см. разделы 2.7 и 7.1).
ДГПЖ
- Эффективность одновременного использования альфа-блокаторов и СИАЛИС для лечения ДГПЖ не была достаточно изучена. Из-за потенциальных сосудорасширяющих эффектов комбинированного использования, которые приводят к снижению артериального давления, комбинация тадалафила и альфа-блокаторов не рекомендуется для лечения ДГПЖ (см. разделы 2.7, 7.1 и 12.2).
- Пациенты, принимающие альфа-блокаторы для лечения ДГПЖ, должны прекратить их прием, как минимум, за сутки до начала ежедневного применения препарата для лечения ДГПЖ.
5.7 Почечная недостаточность
Использование по мере необходимости
Доза препарата должна быть ограничена 5 мг не чаще 1 раза в течение каждых 72 часов у пац. с клиренсом креатинина менее 30 мл/мин или с тяжелой почечной недостаточностью на гемодиализе. Стартовая доза у пациентов с клиренсом креатинина 30-50 мл/мин должна быть 5 мг не чаще 1 раза в сутки, а максимальная доза должна быть ограничена 10 мг не чаще 1 раза в течение 48 часов (см. раздел 8.7).
Ежедневное
Эректильная дисфункция
В связи с повышенным воздействием тадалафила (AUC), ограниченного клинического опыта применения и недостаточного выведения с помощью диализа, ежедневное использование не рекомендуется у пациентов с клиренсом креатинина менее 30 мл / мин. (см. раздел 8.7).
ДГПЖ и ЭД/ДГПЖ
В связи с повышенным воздействием Тадалафила (AUC), ограниченного клинического опыта употребления и недостаточного выведения с помощью диализа, ежедневное применение не рекомендуется у лиц с клиренсом креатинина менее 30 мл / мин. С клиренсом креатинина 30-50 мл / мин стартовая доза составляет 3,5 мг один раз в сутки, с дальнейшим повышением дозы до 5 мг один раз в сутки с учетом индивидуального ответа (см. разделы 2.6, 8.7 и 12.3).
5.8 Печеночная недостаточность
Использование по мере необходимости
У пациентов с легкой или умеренной печеночной недостаточностью доза лекарства не должна превышать 10 мг. Так как информации у пациентов с тяжелой печеночной недостаточностью недостаточно, применение у этой группы не рекомендуется (см. раздел 8.6).
Ежедневное
Ежедневное применение не было достаточно изучено у пациентов с легкой или умеренной печеночной недостаточностью. Поэтому этим пациентам рекомендуют назначать ежедневное использование препарата с осторожностью. Так как информации у пац. с тяжелой печеночной недостаточностью недостаточно, использование у этой группы не рекомендуется (см. раздел 8.6).
5.9 Алкоголь
Пациентов нужно предупреждать о том, что и алкоголь, и CIALIS – ингибитор ФДЭ – действуют, как сосудорасширяющие средства умеренной силы. Когда сосудорасширяющие средства умеренной силы принимают в комбинации, гипотензивные эффекты каждого отдельного вещества могут усиливаться.
Следовательно, врачи должны информировать пациентов, что существенное употребление алкоголя (например, 5 стандартных доз или больше) в сочетании с СИАЛИСОМ может увеличить возможность развития ортостатических симптомов и признаков, включая повышение частоты сердечных сокращений, снижение артериального давления в стоячем положении, головокружение и головную боль (см. раздел Клиническая фармакология (12.2)).
5.10 Одновременное применение сильных ингибиторов цитохрома P450 3A4 (CYP3A4)
СИАЛИС метаболизируется, в основном, в печени с помощью CYP3A4. Дозу при использовании по мере необходимости нужно ограничить 10 мг не чаще 1 раза в течение 72 часов у пациентов, принимающих сильные ингибиторы CYP3A4, такие как ритонавир, кетоконазол и интраконазол (см. раздел Взаимодействие с другими лекарствами (7.2)). У пациентов, принимающих сильные ингибиторы CYP3A4 и ежедневно принимающих CIALIS , максимально рекомендованная доза составляет 2,5 мг (см. раздел 2.7).
5.11 Комбинация с другими ингибиторами ФДЭ5 или препаратами для лечения эректильной дисфункции
Безопасность и эффективность комбинации лекарства и других ингибиторов ФДЭ5 или средства для лечения эректильной дисфункции не изучалась. Рекомендуйте пациентам не принимать его с другими ингибиторами ФДЭ, включая АДЦИРКА.
5.12 Влияние на кровотечение
Исследования in vitro продемонстрировали, что тадалафил является селективным ингибитором ФДЭ5. ФДЭ5 обнаружено в тромбоцитах. При использовании совместно с аспирином, он в дозе 20 мг не удлиняет время кровотечения, в сравнении с употреблением только аспирина. CIALIS не применялся у пац. с кровотечениями или значимыми активными пептическими язвами. Хотя СИАЛИС и не продемонстрировал увеличения времени кровотечения у здоровых людей, его назначение пациентам с кровотечением или значимыми активными пептическими язвами должно быть основано на тщательной оценке риска и пользы.
5.13 Консультирование пациентов об инфекциях, передаваемых половым путем
Не защищает от инфекций, передаваемых половым путем. Рекомендуют консультировать пациентов о защитных мерах, необходимых для профилактики инфекций, передаваемых половым путем, включая вирус иммунодефицита человека (ВИЧ).
5.14 Внимание к другим урологических заболеваний до начала лечения ДГПЖ
Перед началом лечения ДГПЖ нужно уделить внимание другим урологическим заболеваниям, которые могут вызвать подобные симптомы. Кроме этого, рак предстательной железы и ДГПЖ могут существовать одновременно.
Побочные реакции
6.1 Опыт клинических исследований
Так как клинические исследования проводятся в самых различных условиях, распространенность побочных реакций, наблюдаемая в клинических исследованиях одного препарата, не может быть напрямую сопоставлена с их распространенностью в клинических исс. другого лекарства, и может не отображать распространенность, наблюдаемую в практике.
Тадалафил применялся у более 9 000 мужчин во время клинических исс. во всем мире. В исл. ежедневного употребления CIALIS было 1434, 905 и 115 участников, которых лечили в течение, как минимум, 6 месяцев, 1 и 2 лет соответственно. В исследовании по мере необходимости принимали участие более 1300 и 1000 мужчин, принимавших препарат в течение, как минимум, 6 месяцев и 1 года соответственно.
По мере необходимости при эректильной дисфункции
В восьми первичных плацебо-контролируемых клинических исс.продолжительностью в 12 недель, средний возраст участников составлял 59 лет (диапазон от 22 до 88 лет), а частота отказа от лечения вследствие развития побочных эффектов у пациентов, принимаемых тадалафил в дозе 10 или 20 мг составила 3,1%, по сравнению с 1,4% у участников, принимаемых плацебо.
При условии использовании СИАЛИСА по мере необходимости в рекомендованных дозах в плацебо-контролируемых исс. были выявлены следующие побочные эффекты (см. Таблица 1):
Таблица 1: Побочные реакции, вызванные использованием лекарства по мере необходимости (10 или 20 мг) при ЭД, о которых сообщили ?2% пациентов, и которые чаще наблюдались у участников, принимающих его, по сравнению с плацебо. Данные 8 первичных плацебо-контролируемых клинических исследований (включая исс. у пац. с сахарным диабетом).
| Побочная реакция | Плацебо
(N=476) |
Тад. 5 мг
(N=151) |
Тад.10 мг
(N=394) |
Тад. 20 мг
(N=635) |
| Головная боль | 5% | 11% | 11% | 15% |
| Диспепсия | 1% | 4% | 8% | 10% |
| Боль в спине | 3% | 3% | 5% | 6% |
| Миалгия | 1% | 1% | 4% | 3% |
| Заложенность носа | 1% | 2% | 3% | 3% |
| Приливыа | 1% | 2% | 3% | 3% |
| Боль в конечностях | 1% | 1% | 3% | 3% |
аТермин «приливы» включает: приливы крови к лицу и приливы жара.
Ежедневное употребление для лечения ЭД
В трех плацебо-контролируемых клинических исследованиях продолжительностью 12 или 24 недели, средний возраст участников был 58 лет (диапазон от 21 до 82 лет), а частота отказа от лечения вследствие развития побочных эффектов у пациентов, принимаемых тадалафил, составила 4,1%, по сравнению с 2,8% у участников, принимаемых плацебо.
В клинических исс. длительностью 12 недель сообщалось о следующих побочных реакциях (см. Таблицу 2):
Таблица 2 : Побочные реакции, вызванные ежедневным использованием СИАЛИСА (2,5 или 5 мг) для лечения ЭД, о которых сообщили ?2% пациентов, и которые чаще наблюдались у участников, принимающих препарат, по сравнению с плацебо. Данные 3 плацебо-контролируемых клинических исс. длительностью 12 недель (включая иссл. у пац. с сахарным диабетом).
| Побочная реакция | Плацебо
(N=248) |
Тад. 2,5 мг
(N=196) |
Тад. 5 мг
(N=304) |
| Головная боль | 5% | 3% | 6% |
| Диспепсия | 2% | 4% | 5% |
| Назофарингит | 4% | 4% | 3% |
| Боль в спине | 1% | 3% | 3% |
| Инфекции верхних дыхательных путей | 1% | 3% | 3% |
| Приливы | 1% | 1% | 3% |
| Миалгия | 1% | 2% | 2% |
| Кашель | 0% | 4% | 2% |
| Диарея | 0% | 1% | 2% |
| Заложенность носа | 0% | 2% | 2% |
| Боль в конечностях | 0% | 1% | 2% |
| Инфекции мочевыводящих путей | 0% | 2% | 0% |
| Гастроэзофагеальная рефлюксная болезнь | 0% | 2% | 1% |
| Боль в животе | 0% | 2% | 1% |
В одном клиническом исследовании длительностью более 24 недель сообщалось о следующих побочных реакциях (см. Таблицу 3):
Таблица 3: Побочные реакции, вызванные ежедневным применением СИАЛИСА (2,5 или 5 мг) для лечения ЭД, о которых сообщили ?2% пациентов, и которые чаще наблюдались у участников, принимающих препарат, по сравнению с плацебо. Данные 1 плацебо-контролируемого клинического исследования длительностью 24 недели.
| Побочная реакция | Плацебо
(N=94) |
Тад. 2,5 мг
(N=96) |
Тад. 5 мг
(N=97) |
| Назофарингит | 5% | 6% | 6% |
| Гастроэнтерит | 2% | 3% | 5% |
| Боль в спине | 3% | 5% | 2% |
| Инфекции верхних дыхательных путей | 0% | 3% | 4% |
| Диспепсия | 1% | 4% | 1% |
| Гастроэзофагеальная рефлюксная болезнь | 0% | 3% | 2% |
| Миалгия | 2% | 4% | 1% |
| Гипертензия | 0% | 1% | 3% |
| Заложенность носа | 0% | 0% | 4% |
Ежедневное употребление для лечения ЭД и ДГПЖ
В трех плацебо-контролируемых клинических исследованиях длительностью 12 недель (2 исследования – у пациентов с ДГПЖ, 1 – у пациентов с ЭД и ДГПЖ), средний возраст участников был 63 года (диапазон от 44 до 93 лет), а частота отказа от лечения вследствие развития побочных эффектов у пац., принимаемых тадалафил, составила 3,6%, по сравнению с 1,6% у участников, принимаемых плацебо.
Побочные реакции, приведшие к прекращению приема препарата, как минимум, у 2 пац., принимающих таданафил, включали головную боль, боль в верней части живота и миалгию. Сообщалось о следующих побочных реакциях (см. Таблицу 4)
Таблица 4: Побочные реакции, вызванные ежедневным применением СИАЛИСА (5 мг) для лечения ЭД и ДГПЖ, о которых сообщили ?1% пациентов, и которые чаще наблюдались у участников, принимающих препарат, по сравнению с плацебо. Данные 3 плацебо-контролируемых клинических исследований (2 исс. – у пациентов с ДГПЖ, 1 – у пац. с ЭД и ДГПЖ) длительностью 12 недель.
| Побочная реакция | Плацебо
(N=94) |
Тад. 5 мг
(N=97) |
| Головная боль | 2,3% | 4,1% |
| Диспепсия | 0,2% | 2,4% |
| Боль в спине | 1,4% | 2,4% |
| Назофарингит | 1,6% | 2,1% |
| Диарея | 1,0% | 1,4% |
| Боль в конечностях | 0,0% | 1,4% |
| Миалгия | 0,3% | 1,2% |
| Головокружение | 0,5% | 1,0% |
Дополнительные, менее частые побочные реакции (<1%), наблюдаемые в контролируемых клинических исследованиях применения СИАЛИСА при ДГПЖ или ЭД и ДГПЖ, включали: гастроэзофагеальную рефлюксную болезнь, боль в верхней части живота, тошноту, рвоту, артралгию и мышечные спазмы.
Боль в спине или миалгия отмечалась с частотой, отмеченной в Таблицах 1-4. В клинико-фармакологических исследованиях боль в спине или миалгия возникали, как правило, через 12-24 часа после приема препарата и проходили обычно в течение 48 часов.
Боль в спине / миалгия, связанные с лечением тадалафилом, характеризовались диффузным двусторонним мышечным дискомфортом в пояснице, ягодицах, бедрах или грудном отделе спины, и усиливались в положении лежа. Как правило, отмечающаяся боль была легкой или умеренной и проходила без медицинского лечения, но с невысокой частотой (<5% от всех сообщений) наблюдалась сильная боль в спине.
Когда было необходимо медицинское лечение, как правило, эффективными были ацетаминофен нестероидные противовоспалительные средства; тем не менее, у небольшой части пациентов, требовавших лечения, применялся мягкое наркотическое средство (например, кодеин). В целом, примерно 0,5% всех пац., получавших CIALIS по мере необходимости, отказались от лечения вследствие боли в спине / миалгии. В 1-годичном открытом исследовании о боли в спине и миалгии сообщали 5,5% и 1,3% пациентов, соответственно.
Диагностическое обследование, включая оценку воспаления, мышечного повреждения или повреждения почек, не выявило никаких признаков значимой с медицинской точки зрения патологии.
Распространенность этих осложнений при ежедневном употреблении СИАЛИСА для лечения ЭД, ДГПЖ и ДГПЖ/ЭД указана в Таблицах 2,3 и 4. В исследованиях ежедневного применения побочные эффекты в виде болей в спине и миалгии были, как правило, легкими или умеренными, а частота прекращения лечения составила <1% при всех показаниях.
Во всех плацебо-контролируемых исследованиях использования CIALIS по мере необходимости чаще всего о диарее сообщали пациенты 65 лет и старше (2,5% пац.) (см. раздел Применение в отдельных группах населения (8.5)).
Во всех исл. употребления любой дозы сообщения об изменениях цветового зрения были редкими (<0.1% пациентов).
Следующий раздел описывает дополнительные, менее частые события (<2%), о которых сообщалось в контролируемых клинических исследованиях применения CIALIS . Причинная взаимосвязь этих событий с СИАЛИСОМ сомнительная. Из этого списка исключены незначительные события, события, которые не имеют правдоподобной связи с применением препарата, а также слишком неточные сообщения сообщения, не имеющие смысла:
Организм в целом – астения, отек лица, усталость, боль, периферический отек.
Сердечно-сосудистая система – стенокардия, боль в грудной клетке, гипотензия, инфаркт миокарда, постуральная гипотензия, сердцебиение, синкопальные состояния, тахикардия.
Пищеварительный тракт – патологические результаты функциональных тестов печени, сухость во рту, дисфагия, эзофагит, гастрит, повышение уровня ГГТП, жидкий стул, тошнота, боль в верхней части живота, гастроэзофагеальная рефлюксная болезнь, геморроидальное кровотечение, ректальное кровотечение.
Опорно-двигательный аппарат – артралгия, боль в шее.
Нервная система — головокружение, гиперестезия, бессонница, парестезия, сонливость.
Почки – почечная недостаточность.
Дыхательная система – одышка, носовое кровотечение, фарингит.
Кожа и ее придатки – зуд, сыпь, потливость.
Зрение – помутнение зрения, изменения в цветовом зрении, конъюнктивит (включая гиперемию конъюнктивы), боль в глазах, усиление слезотечения, отеки век.
Слух – внезапное ухудшение или потеря слуха, шум в ушах.
Мочеполовая система – усиленная эрекция, спонтанная эрекция полового члена.
6.2 Постмаркетинговые данные
После введения в клиническую практику были выявлены перечисленные ниже побочные реакции. Так как об этих реакциях добровольно сообщали пациентам, не всегда возможно достоверно оценить их частоту и установить причинную связь с его воздействием. Эти случаи отобраны для включения в инструкцию из-за их серьезности, частоты сообщений, отсутствия явных альтернативных причин их появления или из-за комбинации этих факторов.
Сердечно-сосудистая и цереброваскулярная системы – серьезные сердечно-сосудистые события, включая инфаркт миокарда, внезапную сердечную смерть, инсульт, боль в грудной клетке, сердцебиение и тахикардию, были зарегистрированы после начала использования в клинической практике во временной связи с применением тадалафила. Большинство, но не все, этих пациентов имели ранее существовавшие факторы сердечно-сосудистого риска.
Сообщается, что многие из этих событий возникали во время или вскоре после сексуальной активности, и лишь немногие из них возникали вскоре после приема без сексуальной активности. О других событиях сообщалось, что они возникали спустя несколько часов или дней после приема и сексуальной активности.
Невозможно определить, связаны ли эти события непосредственно с приемом СИАЛИСА, сексуальной активностью, наличием у пац.сердечно-сосудистых заболеваний, комбинацией этих факторов или с существованием других факторов (см. раздел Предупреждения и меры предосторожности (5.1)).
Организм в целом – реакции гиперчувствительности, включая крапивницу, синдром Стивенса-Джонсона и эксфолиативный дерматит.
Нервная система – мигрень, судороги, временная глобальная амнезия.
Зрение – дефекты полей зрения, окклюзия вены сетчатки, окклюзия артерии сетчатки. Неартеритическая передняя ичиншемическая невропатия зрительного нерва (НПИНЗН)– причина ухудшение зрения, включая его постоянную полную потерю, о которой были постмаркетинговые сообщения во временной ассоциации с применением ингибиторов ФДЭ5.
Большинство, но не все, из этих пациентов имели существующие анатомические или сосудистые факторы риска развития НПИНЗН, включая (но не обязательно ограничиваясь) следующие: низкое соотношение диаметра экскавации и диска зрительного нерва («застойный» диск зрительного нерва), возраст старше 50 лет, сахарный диабет, гипертензия, ишемическая болезнь сердца, гиперлипидемия и курение.
Невозможно определить, связаны ли напрямую эти случаи с применением ингибиторов ФДЭ-5 или с имеющимися сосудистыми факторами риска и анатомическими дефектами, или с комбинацией этих всех факторов, или с другими факторами (см. раздел Предупреждения и меры предосторожности (5.4)).
Слух – после выхода ингибиторов ФДЭ5, появились сообщения о внезапном ухудшении или потере слуха, связанных по времени с их приемом. В некоторых случаях сообщалось о существовании заболеваний и других факторов, которые могли играть роль в развитии побочных реакций со стороны слуха.
В многих случаях информация о дальнейшем медицинском наблюдении была ограниченной. Определить, связаны ли эти события напрямую с использованием, с существующими у пац. факторами риска потери слуха, с комбинацией этих факторов или с другими факторами, невозможно (см. раздел Предупреждения и меры предосторожности (5.5)).
Мочеполовая система – приапизм (см. раздел Предупреждения и меры предосторожности (5.3)).
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВАМИ
7.1 Возможное фармакодинамические взаимодействия
Нитраты – применение у пациентов, которые принимают органические нитраты в любом виде, противопоказано. В клинико-фармакологических исследованиях сиалис продемонстрировал способность потенцировать гипотензивный эффект нитратов. У пац., которые принимали , когда введение нитратов считается необходимым с медицинской точки зрения в угрожающих жизни ситуациях, после приема последней дозы перед введением нитратов должно пройти, как минимум, 48 часов. В таких ситуациях нитраты должны вводиться только под бдительным медицинским наблюдением с соответствующим гемодинамическим мониторингом (см. разделы Дозировка и способ применения (2.7), Противопоказания (4.1) и Клиническая фармакология (12.2)).
Альфа-блокаторы – следует с осторожностью назначать ингибиторы ФДЭ5 в сочетании с альфа-блокаторами. И ингибиторы ФДЭ5, и альфа-блокаторы являются вазодилататорами с гипотензивными свойствами. Когда вазодилататоры используются в комбинации, можно ожидать их взаимоусиливающего влияния на артериальное давление. Проводились клинико-фармакологические исл. комбинированного использования с доксазозином, тамсулозином или альфузозином (см. разделы Дозировка и способ применения (2.7), Предупреждения и меры предосторожности (5.6)и Клиническая фармакология (12.2)).
Антигипертензивные средства – Ингибиторы ФДЭ5, являются слабыми системными вазодилататорами. Были проведены клинико-фармакологические исследования для оценки влияния сиалиса на усиление гипотензивных эффектов определенных антигипертензивных препаратов (амлодипин, блокаторы рецепторов ангиотензина II, бендрофлазид, эналаприл и метопролол).
Вследствие совместного применения тадалафила с этими лекарствами возникло небольшое снижение артериального давления, по сравнению с плацебо (см. разделы Предупреждения и меры предосторожности (5.6)и Клиническая фармакология (12.2)).
Алкоголь – алкоголь и ингибитор ФДЭ5 – действуют, как слабые вазодилататоры. Когда слабые вазодилататоры принимаются в комбинации, гипотензивные эффекты каждого из них могут усиливаться.
Существенное употребление алкоголя (например, 5 стандартных доз или больше) в сочетании с СИАЛИСОМ может увеличить возможность развития ортостатических симптомов и признаков, включая повышение частоты сердечных сокращений, снижение артериального давления в стоячем положении, головокружение и головную боль.
Тадалафил не влияет на концентрацию алкоголя в плазме крови, а алкоголь не влияет на концентрации его в плазме крови (см. разделы Предупреждения и меры предосторожности (5.9)и Клиническая фармакология (12.2)).
7.2 Возможности других лекарств влиять на сиалис
(см. разделы Дозировка и способ применения (2.7), Предупреждения и меры предосторожности (5.10)).
Антациды – Одновременный прием антацидов (гидроксид магния / гидроксид алюминия) и тадалафила снижает скорость абсорбции без влияния на экспозицию (AUC).
strong-антагонисты – Повышение желудочного pH после приема низатидина не имело значимого влияния на фармакокинетику
Ингибиторы цитохрома P450 – это вещество, которое метаболизируется преимущественно CYP3A4. Исследования продемонстрировали, что препараты, которые подавляют CYP3A4, могут усилить усиливают концентрацию тадалафила в плазме.
CYP3A4 (например, кетоконазол) – Кетоконазол (400 мг в день), селективный и сильный ингибитор CYP3A4, повышает AUC (площадь под кривой «концентрация-время») одной дозы 20 мг Тад. на 312%, а Cmax на 22%, по сравнению с этими показателями для приема только 20 мг.
Кетоконазол (200 мг в день) повышает AUC одной дозы 10 мг тадалафила на 107%, а Cmax на 15%, по сравнению с этими показателями для приема только 10 мг тадалафила (см. раздел Дозировка и способ применения (2.7)).
Хотя специфические взаимодействия не были изучены, другие ингибиторы CYP3A4, такие как эритромицин, интраконазол и грейпфрутовый сок, скорее всего, увеличивают его концентрацию в плазме.
Ингибиторы ВИЧ-протеазы – Ритонавир (500 или 600 мг два раза в день) – ингибитор CYP3A4,
CYP2C9, CYP2C19 и CYP2D6 — повышает AUC (площадь под кривой «концентрация-время») одной дозы 20 мг Тад. на 32%, а Cmax снижает на 30%, по сравнению с этими показателями для приема только 20 мг Тад.. Ритонавир (200 мг два раза в день повышает AUC одной дозы 20 мг тад. на 124%, а Cmax не изменяет, по сравнению с этими показателями для приема только 20 мг тад. . Хотя специфические взаимодействия не были изучены, другие ингибиторы ВИЧ-протеазы, скорее всего, увеличивают концентрацию тадалафила в плазме (см. раздел Дозировка и способ применения (2.7)).
Индукторы цитохрома P450 – Исследования показали, что препараты, индуцирующие CYP3A4, могут снизить концентрацию тадалафила в плазме крови.
CYP3A4 (например, рифампицин) – Рифампицин (600 мг в день) – индуктор CYP3A4 – снижает AUC (площадь под кривой «концентрация-время») одной дозы 10 мг тад. на 88%, а Cmax на 46%, по сравнению с этими показателями для приема только 10 мг тад. .
Хотя специфические взаимодействия не были изучены, другие индукторы CYP3A4, такие как карбамазепин, фенитоин и фенобарбитал, могут снижать концентрацию тадалафила в плазме крови. Коррекция дозы не требуется. Уменьшение концентрации в плазме крови при совместном применении с рифампицином или другими индукторами CYP3A4 предположительно может снизить эффективность ежедневного использования СИЛАЛИСА; степень снижения эффективности неизвестна.
7.3 Возможность влиять на другие лекарства
Аспирин – тад. не потенцирует увеличение времени кровотечения, вызванное аспирином.
Субстраты цитохрома P450 — предположительно не вызывает клинически значимого ингибирования или индукции клиренса препаратов, метаболизируемых изоформами цитохрома P450. Исследования показали, что тадалафил не ингибирует и не индуцирует следующие изоформы P450 — CYP1A2, CYP3A4, CYP2C9, CYP2C19, CYP2D6 и CYP2E1.
CYP1A2 (например, теофиллин) – тад. не оказывает значимого влияния на фармакокинетику теофиллина. Когда люди, принимающие теофиллин, принимали его, наблюдалось небольшое увеличение (на 3 удара в минуту) частоты сердечных сокращений, связанное с теофиллином.
CYP2C9 (например, варфарин) – тад. не оказывает существенное влияние на концентрацию S-варфарина или R-варфарина в плазме крови, а также не влияет на изменения протромбинового времени, вызванное варфарином.
CYP3A4 (например, мидазолам или ловастатин) — тад. не оказывает существенное влияние на концентрацию мидазолама или ловастатин в плазме крови.
P-гликопротеин (например, дигоксин) – Совместное применение тадалафила (40 мг один раз в день) в течение 10 дней не оказывало существенного влияния на фармакокинетику дигоксина (0,25 мг / день) у здоровых людей.
ПРИМЕНЕНИЕ В ОТДЕЛЬНЫХ ГРУППАХ НАСЕЛЕНИЯ
8.1 Беременность
Категория риска для плода по FDA – B. не показан для применения у женщин. Адекватных и хорошо контролируемых исл. употребления СИАЛИСА у беременных женщин нет.
Общий риск – На основании данных у животных можно спрогнозировать, что не увеличивает риск появления неблагоприятных аномалий развития у людей.
Данные у животных – Исс.репродукции у животных продемонстрировали отсутствие доказательств тератогенности, эмбриотоксичности или фетотоксичности, когда тадалафил вводили беременным самкам мышей или крыс при воздействии дозы, в 11 раз превышающей максимально рекомендуемую дозу у людей (МРДЛ) 20 мг/сутки, во время органогенеза.
В одном из двух перинатальных / постнатальных исс.развития у крыс, послеродовая выживаемость потомства снижалась после воздействия тадалафила на организм матери в дозах, которые в 10 раз превышают МРДЛ на основе AUC. Выжившее потомство имело нормальное развитие и репродуктивные способности.
В исследовании пренатального и постнатального развития у крыс при дозе 60, 200 и 1000 мг / кг наблюдалось уменьшение постнатальной выживаемости у потомства.
Уровень отсутствия влияния для материнской токсичности был 200 мг / кг / день, а у токсичности для развития потомства – 30 мг / кг / день. Это составляет примерно 16 и 10-кратную величину по сравнению с концентрацией тадалафила в плазме крови у людей при МРДЛ (20 мг).
Тад. и / или его метаболиты проникают через плаценту, что приводит к его воздействию на плод у крыс.
8.3 Грудное вскармливание
Не показан для применения у женщин. Тадалафил и / или его метаболиты секретируются в молоко у крыс в концентрациях, которые примерно в 2,4 раза превышают концентрацию препарата в плазме крови.
8.4 Применение у детей
Не показан для применения у детей. Безопасность и эффективность у пациен. моложе 18 лен не была изучена.
8.5 Применение у пожилых людей
Из общего числа участников в клинических исследованиях применения тадалафила при ЭД, примерно 19% имели 65 лет и больше, а около 2% — 75 лет и больше. Из общего числа участников в клинических исл. использование при ДГПЖ (включая исследования ДГПЖ / ЭД), примерно 40% имели 65 лет и больше, а около 10% — 75 лет и больше.
В этих клинических исследованиях не наблюдалось никаких различий в эффективности или безопасности между пожилыми (возраст >65 и ?75) и более молодыми (возраст ?65 лет) участниками. Однако в плацебо-контролируемых исл. применения CIALIS по мере необходимости при ЭД, у пацие. старше 65 лет, принимавших , чаще наблюдалась диарея (у 2,5% пациентов) (см. раздел Побочные реакции (6.1)).
Коррекция дозы на основании одного лишь возраста не оправдана. Однако следует повышенную чувствительность к лекарствам у некоторых пожилых людей (см. раздел Клиническая фармакология (12.3)).
8.6 Печеночная недостаточность
В клинико-фармакологических исследованиях AUC (концентрация в плазме крови) у людей с легкой или умеренной печеночной недостаточностью (Класс А или В по Чайлд-Пью) была сравнимой с концентрацией в плазме у здоровых людей, когда применялась доза 10 мг.
Нет данных о дозах, превышающих 10 мг тадалафила, у пациентов с печеночной недостаточностью. Недостаточно данных у пацие.н с тяжелой печеночной недостаточностью (Класс С по Чайлд-Пью) (см. разделы Дозировка и способ применения (2.6) и Предупреждения и меры предосторожности (5.8)).
8.7 Почечная недостаточность
В клинико-фармакологических исследованиях с применением одной дозы тадалафила (5-10 мг), у людей с клиренсом креатинина 30-80 мл / мин концентрация препарата в плазме крови (AUC) удваивалась. У пациен. с терминальной стадией почечной недостаточности на гемодиализе после одной дозы 10 или 20 мг тадалафила наблюдалось 2,4-4,8-кратное повышение AUC и двукратное повышение Cmax.
Концентрация в плазме метилкатехола (неконъюгированного и глюкуронида) была в 2-4 раза выше у пациен. с почечной недостаточностью, по сравнению с здоровыми людьми. Гемодиализ (проведенный в период времени от 24 до 36 часов после приема препарата) приводил к ничтожно малой элиминации тадалафила или его метаболитов.
В клинико-фармакологическом исследовании (N=28) препарата в дозе 10 мг у мужчин с клиренсом креатинина 30-50 мл / мин наблюдалось побочное действие – боль в пояснице. В дозе 5 мг частота и тяжесть боли в пояснице существенно не отличались от таковых у населения в целом.
У пациен. на гемодиализе, принимающих 10 или 20 мг тадалафила, случаев боли в пояснице не было зарегистрировано (см. разделы Дозировка и способ применения (2.6) и Предупреждения и меры предосторожности (5.7)).
ПЕРЕДОЗИРОВКА
Однократно применялся здоровыми людьми в дозе до 500 мг, а многократно ежедневно – в дозе 100 мг. Побочные эффекты были подобны тем, что наблюдались при применении меньших доз препарата. В случаях передозировки по мере необходимости должны использоваться стандартные поддерживающие меры. Гемодиализ ничтожно мало влияет на элиминацию тадалафила.
Клиническая фармакология
12.1 Механизм действия
Эрекция полового члена во время сексуальной стимуляции вызвана повышением кровотока в нем в результате расслабления гладких мышц артерий полового члена и пещеристых тел. Этот ответ опосредуется высвобождением из нервных окончаний и эндотелиальных клеток оксида азота (NO), который стимулирует синтез цГМФ в гладкомышечных клетках. Циклический ГМФ вызывает расслабление гладких мышц и усиление притока крови в пещеристые тела.
Подавление фосфодиэстеразы 5 типа (ФДЭ5) усиливает эректильную функцию с помощью повышения количества цГМФ. Тадалафил ингибирует ФДЭ5. Так как для инициации местного высвобождения оксида азота нужна сексуальная стимуляция, подавление ФДЭ5 тадалафилом не оказывает никакого влияния при отсутствии сексуальной стимуляции.
Влияние ингибирования ФДЭ5 на концентрацию цГМФ в пещеристых телах и легочных артериях также наблюдается в гладких мышцах предстательной железы, мочевого пузыря и кровоснабжающих их сосудах. Механизм снижения симптомов ДГПЖ не был установлен.
Исследования in vitro продемонстрировали, что тадалафил является селективным ингибитором ФДЭ5. ФДЭ5 находится в гладких мышцах пещеристого тела, предстательной железы и мочевого пузыря, а также в сосудистых и висцеральных гладких мышцах, скелетных мышцах, мочеиспускательном канале, тромбоцитах, почках, легких, мозжечку, сердце, печени, яичках, семенных пузырьках и поджелудочной железе.
Исследования in vitro продемонстрировали, что влияние на ФДЭ5 более сильное, чем на другие типы фосфодиэстеразы. Эти исс. показали, что он более чем в 10 000 раз сильнее действует на ФДЭ5, чем на ФДЭ1, ФДЭ2, ФДЭ4 и ФДЭ7, которые находятся в сердце, головном мозге, кровеносных сосудах, печени, лейкоцитах, скелетных мышцах и других органах. Тадалафил более чем в 10 000 раз сильнее действует на ФДЭ5, чем на ФДЭ3, которая содержится в сердце и кровеносных сосудах. Кроме этого, тадалавил в 700 раз сильнее действует на ФДЭ5, чем на ФДЭ6, которая обнаруживается в сетчатке и отвечает за фототрансдукцию.
Тад. более чем в 9 000 раз сильнее действует на ФДЭ5, чем на ФДЭ8, ФДЭ9 и ФДЭ10. В 14 раз сильнее действует на ФДЭ5, чем на ФДЭ11А1, и в 40 раз сильнее, чем на ФДЭ11А4 – две из четырех известных форм ФДЭ11. ФДЭ11 обнаруживается в предстательной железе, яичках, скелетных мышцах и других тканях (например, в коре надпочечников) человека. In vitro тадалафил ингибирует рекомбинантный ФДЭ11А1 и, в меньшей степени, активность ФДЭ11А4 в концентрации в терапевтическом диапазоне. Физиологическая роль и клинические последствия ингибирования ФДЭ11 у людей не были определены.
12.2 Фармакодинамика
Влияние на артериальное давление
20 мг тад. , принятые здоровым мужчиной, не вызывает существенных различий по сравнению с плацебо в систолическом и диастолическом давлении в положении лежа на спине (разница в среднем максимальном снижении 1,6 / 0,8 мм рт.ст., соответственно) и в в систолическом и диастолическом давлении в положении стоя (разница в среднем максимальном снижении 0,2 / 4,6 мм рт.ст., соответственно). Кроме этого, не было обнаружено существенного влияния на частоту сердечных сокращений.
Влияние на артериальное давление при совместном применении с нитратами
В клинико-фармакологических исследованиях тад. (от 5 до 20 мг) продемонстрировал потенцирование гипотензивного эффекта нитратов. Таким образом, применение СИАЛИСА у принимающих любую форму нитратов, противопоказано (см. раздел Противопоказания (4.1)).
Было проведено иссл. по оценке степени взаимодействия между нитроглицерином и тадалафилом, если в экстренной ситуации было необходимым введение нитроглицерина после приема CIALIS . Это было двойное слепое, плацебо-контролируемое, перекрестное иссл. с 150 участниками, достигших возраста 40 лет (включая лиц с сахарным диабетом и / или контролируемой гипертензией) и получающих ежедневные дозы 20 мг сиалиса или плацебо в течение 7 дней. Участники принимали под язык 40 мг нитроглицерина (НТГ) в заранее определенные моменты времени, после их последней дозы тадалафила (через 2, 4, 8, 24,48, 72 и 96 часа после приема).
Целью исследования было определить когда после приема не наблюдалось явного взаимного влияния на артериальное давление. В этом исс. существенное взаимодействие между тадалафилом и НТГ наблюдалось в каждый момент времени вплоть до 24 часов включительно.
Через 48 часов – по большинству гемодинамических показателей – взаимодействие между лекарством и НТГ не наблюдалось, хотя у еще нескольких пациен., принимавших тадалафил, в это время наблюдалось снижение артериального давления, по сравнению с плацебо. Через 48 часов взаимодействие не было обнаружено (см. Рисунок 1)
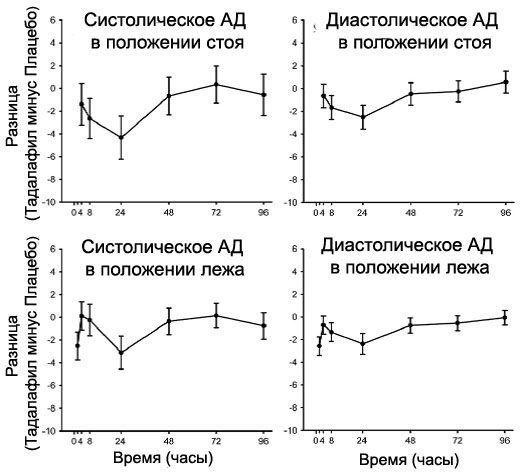
Таким образом, совместное применение СИАЛИСА с нитратами противопоказано. У пациен., принимавших препарат, когда использование нитратов является необходимым с медицинской точки зрения при опасных для жизни ситуациях, должно пройти, как минимум, 48 часов после приема последней дозы CIALIS перед введением нитратов.
В таких условиях нитраты должны вводится только под тщательным медицинским контролем с соответствующим гемодинамическим мониторингом (см. раздел Противопоказания (4.1)).
Влияние на артериальное давление при совместном использовании с альфа-блокаторами
Для оценки потенциального взаимодействия тад с альфа-блокаторами были проведены 6 рандомизированных, двойных слепых, перекрестных клинико-фармакологических исс. у здоровых мужчин (см. разделы Дозировка и способ применения (2.7) и Предупреждения и меры предосторожности (5.6)).
В 4 исследованиях здоровые мужчины, ежедневно принимающие пероральные альфа-блокаторы (в течение, как минимум, 7 дней), принимали одну дозу тадалафила. В 2 исс. ежедневный пероральный прием альфаблокаторов (длительностью, как минимум, 7 дней) начинали у здоровых мужчин, принимавших повторяющиеся ежедневные дозы тад.
Доксазозин – Три клинико-фармакологических исс. проводились с тад и доксазозином – альфа(1)-адреноблокатор.
В первом исследовании доксазозина одна пероральная доза 20 мг тадалафила или плацебо принималась здоровыми лицами, принимавшими ежедневно 8 мг доксазозина (N = 18 участников). Доксазозин принимался одновременно с тадалафилом или плацебо после, как минимум, 7 дней применения доксазозина (см. Таблица 5 и рисунок 2).
Таблица 5: Доксазозин (8 мг / сутки) Исс.е 1: Среднее максимальное снижение (95% ДИ) систолического артериального давления
| Вычитаемое с плацебо среднее максимальное снижение систолического артериального давления (мм рт.ст.) | 20 мг |
| В положении лежа на спине | 3,6 (-1,5; 8,8) |
| В положении стоя | 9,8 (4,1; 15,5) |

Артериальное давление измерялось вручную через 1, 2, 3, 4, 5, 6, 7, 8, 10, 12 и 24 часа после приема тадалафила или плацебо. Участниками с резко отклоняющимися наблюдениями (outliers) считались лица с систолическим артериальным давлением в положении стоя <85 мм рт.ст. или снижением систолического артериального давления в положении стоя на >30 мм рт.ст. по сравнению с исходным уровнем в одной или нескольких временных точек.
Было 9 и 3 участника резко отклоняющимися наблюдениями после приема 20 мг тадалафила и плацебо, соответственно. 5 и 2 участника с резко отклоняющимися наблюдениями были из-за снижения систолического артериального давления в положении стоя на >30 мм рт.ст., а 5 и 1 участник – из-за снижения систолического АД в положении стоя <85 мм рт.ст. после приема 20 мг тадалафила и плацебо, соответственно. Были оценены тяжелые неблагоприятные события, потенциально связанные с влиянием на артериальное давление.
После приема плацебо таких событий не было. У тадалафила наблюдалось два таких события. Один участник сообщил о появлении через 7 часов после приема препарата вертиго (головокружение), которое длилось примерно 5 дней. Этот участник ранее испытывал легкие вертиго на доксазозине и плацебо.
Второй участник сообщил о головокружении, которое началось через 25 минут после приема тадалафила и длилось 1 день. О синкопальных состояниях не сообщалось.
Во втором исследовании доксазозина однократный пероральный прием 20 мг тадалафила проводился у здоровых лиц, принимающих перорально доксазозин в дозе 4 или 8 мг в день. Исс. (N=72 участника) было проведено в три этапа, каждый из которых состоял из 3х перекрестных периодов.
В части А (N=24) участникам титровали дозу доксазозина до 4 мг, принимаемых каждый день в 8 часов. Тадалафил принимался либо в 8 часов утра, либо в 16-00, либо в 20-00. Плацебо-контроль не проводился.
В части В (N=24) участникам титровали дозу доксазозина до 4 мг, принимаемых каждый день в 8 часов. Тадалафил принимался либо в 8 часов утра, либо в 16-00, либо в 20-00. Плацебо-контроль не проводился.
В части С (N=24) ) участникам титровали дозу доксазозина до 8 мг, принимаемых каждый день в 8 часов. В этой части исс. тадалафил или плацебо принимались либо в 8 часов утра, либо в 20-00.
Вычитаемое с плацебо среднее максимальное снижение систолического артериального давления в течение 12 часового периода после приема препаратов в плацебо-контролируемой части исследования (часть С) показано в Таблице 6 и Рисунке 3.
Таблица 6: Доксазозин (8 мг / день), Исслед. 2 (часть С): Среднее максимальное снижение систолического артериального давления
| Вычитаемое с плацебо среднее максимальное снижение систолического артериального давления (мм рт.ст.) | Тадалафил 20 мг в 08-00 | Тадалафил 20 мг в 08-00 |
| Амбулаторный мониторинг артериального давления (АМАД) | 7 | 8 |

Артериальное давление измеряли с помощью АМАД каждые 15-30 минут в течение 36 часов после приема тадалафила или плацебо. Резко отклоняющимися наблюдениями считалось один или больше показателей артериального давления <85 мм рт.ст. или одно или больше снижение систолического артериального давления на >30 мм рт.ст., по сравнению с исходными значениями, возникшие в течение интервала анализа.
Из 24 участником части С 16 попали в резко отклоняющиеся наблюдения после приема тадалафила, а 6 – в резко отклоняющиеся наблюдения после приема плацебо в течение 24 часов после приема в 08-00 сиалиса или плацебо.
Из них 5 и 2 участника с резко отклоняющиеся наблюдения были с систолическим АД <85 мм рт.ст., тогда как 15 и 4 участника с резко отклоняющиеся наблюдения были со снижением систолического АД на >30 мм рт.ст., по сравнению с исходными значениями, в группах приема тадалафила и плацебо, соответственно.
Некоторые участники в группах тадалафила и плацебо были дополнительно категоризированы в резко отклоняющиеся наблюдения после истечения 24 часов.
Были оценены тяжелые неблагоприятные события, потенциально связанные с влиянием на артериальное давление. В исслед. (N=72 участника) было сообщено о двух случаях таких событий после приема сиалиса (симптоматическая гипотензия у одного участника, которая началась через 10 часов после приема и длилась примерно час; и головокружение у другого участника, которое появилось через 11 часов после приема и длилось 2 минуты).
В группе плацебо сообщений о таких событиях не было. В период до приема тадалафила сообщалось об одном тяжелом событии (головокружение) у участника, принимавшего доксазозин.
В третьем исследовании доксазозина здоровые участники (N=45 участников, 37 из которых завершили исс.) получали лечение 5 мг CIALIS иалиса или плацебо в течение 28 дней в двухэтапном перекрестном исс.. Через 7 дней начинался прием доксазозина в дозе 1 мг, которая титровалась до 4 мг в течение 21 дня каждый период (7 дней по 1 мг, 7 дней по 2 мг, 7 дней по 4 мг доксазозина). Результаты показаны в таблице 7.
Таблица 7: Доксазозин, исс. 3: среднее максимальное снижение (95% ДИ) в систолическом артериальном давлении
| Вычитаемое с плацебо среднее максимальное снижение систолического артериального давления | Тадафил 5 мг | |
| 1-й день приема доксазозина | В положении лежа | 2,4 (0,4; 5,2) |
| В положении стоя | -0,5 (-4,0; 3,1) | |
| 7-й день приема доксазозина | В положении лежа | 2,8 (-0,1; 5,7) |
| В положении стоя | 1,1 (-2,9; 5,0) | |
Артериальное давление измерялось вручную перед приемом препарата в двух временных точках (-30 и -15 минут), а затем через 1, 2, 3, 4, 5, 6, 7, 8, 10, 12 и 24 часа в первый день после приема каждой новой дозы доксазозина (1 мг, 2 мг и 4 мг), а также на седьмой день приема 4 мг доксазозина.
После первого приема доксазозина в дозе 1 мг ни один участник в группе 5 мг тадалафила не попал в резко отклоняющиеся наблюдения, а в группе плацебо в резко отклоняющиеся наблюдения попал один участник из-за снижения систолического АД в положении стоя на >30 мм рт.ст., по сравнению с исходными значениями.
После первого приема доксазозина в дозе 2 мг в группе 5 мг сиалиса в резко отклоняющиеся наблюдения попало 2 участника, а в группе плацебо – ни один участник, из-за снижения систолического АД в положении стоя на >30 мм рт.ст., по сравнению с исходными значениями.
После первого приема доксазозина в дозе 4 мг в группе 5 мг тадалафила в резко отклоняющиеся наблюдения не попал ни один участник, а в группе плацебо – попало 2 участника, из-за снижения систолического АД в положении стоя на >30 мм рт.ст., по сравнению с исходными значениями. После первого приема доксазозина в дозе 4 мг в группе 5 мг сиалиса в резко отклоняющиеся наблюдения попал один участник, в группе плацебо – 3 участника, из-за артериального давления в положении стоя <85 мм рт.ст.
После седьмого дня приема 4 мг доксазозина в группе 5 мг тадалафила в резко отклоняющиеся наблюдения не попал ни один участник, а в группе плацебо у одного участника был снижение систолического АД в положении стоя на >30 мм рт.ст., а еще у одного – уровень систолического АД в положении стоя <85 мм рт.ст. Все неблагоприятные события, потенциально связанные с влиянием на артериальное давление, были легкими или умеренными. Было два эпизодасинкопальных состояний в этом исслед., у одного участника после приема только 5 мг тадалафила, у второго – после совместного приема 5 мг тадалафила и 4 мг доксазозина.
Тамсулозин – В первом исследовании тамсулозина однократная пероральная доза 10 мг, 20 мг тадаладила или плацебо применялась у здоровых участников, принимающих 0,4 мг тамсулозина в день – селективного альфа-адреноблокаторы (N=18 участников). Тадалафил или плацебо принимались через 2 часа после тамсулозина после, как минимум, 7 дней приема тамсулозина.
Таблица 8: Тамсулозин (0,4 мг / сутки), Исслед. 1: Среднее максимальное снижение (95% ДИ) систолического артериального давления
| Вычитаемое с плацебо среднее максимальное снижение систолического артериального давления (мм рт.ст.) | Тадалафил 10 мг | Тадалафил 20 мг |
| В положении лежа | 3,2 (-2,3; 8,6) | 3,2 (-2,3; 8,7) |
| В положении стоя | 1,7 (-4,7; 8,1) | 2,3 (-4,1; 8,7) |
Артериальное давление измерялось вручную через 1, 2, 3, 4, 5, 6, 7, 8, 10, 12 и 24 часа после приема тадалафила или плацебо. В резко отклоняющиеся наблюдения попало 2 , 2 и 1 участник (лица со снижением систолического АД в положении стоя на >30 мм рт.ст., по сравнению с исходными значениями, в одной или больше временных точках) после приема 10, 20 мг тадалафила или плацебо, соответственно. Участников с систолическим АД в положении стоя <85 мм рт.ст. не было. Сообщений о тяжелых неблагоприятных событиях, потенциально связанных с влиянием на артериальное давление, не было. Сообщений о синкопальных состояниях не было.
Во втором исследовании тамсулозина здоровые участники (N=39 участников, 35 из которых завершили исс.)получали в течение 14 дней один раз в сутки тадалафил 5 мг или плацебо по 2-этапной перекрестной схеме. Ежедневная доза 0,4 мг тамсулозина была добавлена в течение последних 7 дней каждого периода.
Таблица 9: Тамсулозин, исслед.е 2: среднее максимальное снижение (95% ДИ) систолического артериального давления
| Вычитаемое с плацебо среднее максимальное снижение систолического артериального давления | Тадафил 5 мг | |
| 1-й день приема 0,4 мг тамсулозина | В положении лежа | -0,1 (-2,2; 1,9) |
| В положении стоя | 0,9 (-1,4; 3,2) | |
| 1-й день приема 0,4 мг тамсулозина | В положении лежа | 1,2 (-1,2; 3,6) |
| В положении стоя | 1,2 (-1,0; 3,5) | |
Артериальное давление измерялось вручную перед приемом в двух временных точках (-30 и -15 минут), а затем через 1, 2, 3, 4, 5, 6, 7, 8, 10, 12 и 24 часа после приема тамсулозина в первый, шестой и седьмой день. Резко отклоняющихся наблюдений не было (участники со снижением систолического АД в положении стоя на >30 мм рт.ст., по сравнению с исходными значениями, в одной или больше временных точках). Один участник, принимавший плацебо и тамсулозин (7 день), и один участник, принимавший тадалафил и тамсулозин (6 день), имели систолическое артериальное давление в положении стоя <85 мм рт.ст. Сообщений о тяжелых неблагоприятных событиях, потенциально связанных с влиянием на артериальное давление, не было.
Альфузозин – Однократная пероральная доза 20 мг тадалафила или плацебо вводилась в –этапном, перекрестном исследовании здоровым участникам, принимающим один раз в день 10 мг гидрохлорида альфузозина – альфа-адреноблокатор – в таблетках с продленным высвобождением (N=17 участников, завершивших исслед.е). Тадалафил или плацебо принимались через 4 часа после альфузозина спустя, как минимум, 7 дней приема альфузозина.
Таблица 5: Альфузозин (10 мг / сутки) Исследование: Среднее максимальное снижение (95% ДИ) систолического артериального давления
| Вычитаемое с плацебо среднее максимальное снижение систолического артериального давления (мм рт.ст.) | Тадалафил 20 мг |
| В положении лежа на спине | 2,2 (-0,9; -5,2) |
| В положении стоя | 4,4 (-0,2; 8,9) |
Артериальное давление измерялось вручную через 1, 2, 3, 4, 5, 6, 7, 8, 10, 12 и 24 часа после приема тадалафила или плацебо. В резко отклоняющиеся наблюдения попал 1 участник (снижение систолического артериального давления в положении стоя <85 мм рт.ст.) после приема 20 мг тадалафила. Участников со снижением систолического АД в положении стоя на >30 мм рт.ст., по сравнению с исходными значениями, в одной или больше временных точках, не было. Сообщений о тяжелых неблагоприятных событиях, потенциально связанных с влиянием на артериальное давление, не было. Сообщений о синкопальных состояниях не было.
Влияние на артериальное давление при совместном применении с антигипертензивными препаратами
Амлодипин – Для изучения взаимодействий между амлодипином (5 мг в день) и тадалафилом в дозе 10 мг было проведено исследование. Не наблюдалось никакого влияния тадалафила на уровни амлодипина в крови, как и влияния амлодипина на уровни тадалафила в крови. Среднее снижение систолического/диастолического давление после приема 10 мг сиалиса у пациентов, принимающих амлодипин, составляло 3/2 мм рт.ст., по сравнению с плацебо. В аналогичном исслед. с приемом 20 мг тадалафила, существенных различий между тадалафилом и плацебо у участников, принимающих амлодипин.
Блокаторы рецепторов ангиотензина II (с или без других антигипертензивных средств) – Было проведено исследование для изучения взаимодействий блокаторов рецепторов ангиотензина II и тадалафилом в дозе 20 мг. Участники исслед. принимали любой доступный на рынке блокатор рецепторов ангиотензина II, либо отдельно, либо в составе комбинированных препаратов, либо в составе комбинированного режима антигипертензивной терапии. После приема, амбулаторные измерения артериального давления выявили различия между тадалафилом и плацебо в 8/4 мм рт.ст. систолического/диастолического артериального давления.
Бендрофлазид – Было проведено исслед., изучающее взаимодействие бендрофлазида (2,5 мг в день) и 10 мг тадалафила. После приема среднее снижение систолического/диастолического артериального давления в лежачем положении, связанное с 10 мг CIALIS , у пациентов, принимающих бендрофлазид, составило 6/4 мм рт.ст., по сравнению с плацебо.
Эналаприл – Было проведено исследование, изучившее взаимодействие эналаприла (10 или 20 мг в день) и сиалиса в дозе 10 мг. После приема среднее снижение систолического/диастолического артериального давления в лежачем положении, связанное с 10 мг тадалафила, у пациен., принимающих эналаприл, составило 4/1 мм рт.ст., по сравнению с плацебо.
Метопролол — Было проведено исслед., изучившее взаимодействие метопролола продленного действия (25-200 мг в день) и тадалафила в дозе 10 мг. После приема препаратов среднее снижение систолического/диастолического артериального давления в лежачем положении, связанное с 10 мг тадалафила, у пациен., принимающих метопролол, составило 5/3 мм рт.ст., по сравнению с плацебо.
Влияние на артериальное давление при совместном приеме с алкоголем
Алкоголь и ингибиторы ФДЭ5, включая тадалафил, являются слабыми системными вазодилататорами. Взаимодействие тадалафила с алкоголем было изучено в 3 клинико-фармакологических исследованиях. В 2 из них алкоголь принимался в дозе 0,7 г / кг, что эквивалентно примерно 140 мл 40-градусной водки у мужчины весом 80 кг, а тадалафил принимался в дозе 10 мг в одном исслед. и 20 мг – в другом.
В обеих этих исследованиях участники принимали всю дозу алкоголя за 10 минут. В одном из этих двух исслед. были подтверждены уровни алкоголя в крови 0,08%. В этих двух исслед. у большинства пациен. наблюдалось клинически значимое снижение артериального давления при комбинации тадалафила и алкоголя, по сравнению с одним только алкоголем.
Некоторые участники сообщали об постуральном головокружении, у некоторых участников наблюдалась ортостатическая гипотензия. Когда 20 мг тадалафила принимался с более низкой дозой алкоголя (0,6 г / кг, что эквивалентно примерно 120 мл 40-градусной водки, принятой менее чем за 10 минут), ортостатическая гипотензия не наблюдалась, головокружение возникало с аналогичной частотой, как и при употреблении одного лишь алкоголя, а гипотензивные эффекты алкоголя не усиливались.
Тадалафил не влияет на концентрацию алкоголя в плазме крови, а алкоголь не влияет на концентрацию тадалафила в плазме крови.
Влияние на стресс-тест
Влияние на функции сердца, гемодинамику и толеронтность к физической нагрузке были оценены в одном клинико-фармакологическом исследовании. В этом слепом перекрестном исслед. приняло участие 23 человека со стабильной ишемической болезнью сердца и доказательствами вызываемой физической нагрузкой ишемией сердца. Первичной конечной точкой исслед. было время до возникновения ишемии сердца.
Средняя разница в общем времени физических упражнений составила 3 секунды (10 мг тадалафила минус плацебо), что не было клинически значимым. Дальнейший статистический анализ продемонстрировал, что не уступал плацебо по времени ишемии. Следует отметить, в этом исслед. у некоторых участников, при последующем сублингвальном приеме нитроглицерина после физической нагрузки, наблюдалось клинически значимое снижение артериального давления, что согласуется с усилением тадалафилом гипотензивных эффектов нитратов.
Влияние на зрение
Однократные дозы ингибиторов фосфодиэстеразы продемонстрировали транзиторное дозозависимое ухудшение различение цветов (синий / зеленый) при проведении теста Фарнсворта-Манселла на цветовосприятие, с наиболее сильным влиянием в момент пиковой концентрации в крови. Этот результат согласуется с ингибированием ФДЭ6, которая участвует в фототрансдукции в сетчатке. В исслед. по оценке эффектов однократного приема 40 мг тадалафила на зрение не наблюдалось влияния на остроту зрения, внутриглазное давление или размеры и реакцию зрачков. Во всех клинических исслед. CIALIS сообщения об изменении цветового зрения были редкими (<0.1% пациентов).
Влияние на характеристику спермы
Были проведены три исследования у мужчин, изучившие потенциальное влияние на характеристики спермы 10 мг (одно 6-месячное исслед.) и 20 мг (одно 6-месячное и одно 9-месячное исслед.) тадалафила, принимаемого ежедневно. Ни в одном из этих исслед. не было обнаружено неблагоприятного влияния на морфологию или подвижность сперматозоидов.
В исслед. приема 10 мг тадалафила в течении 6 месяцев и приема 20 мг сиалиса в течение 9 месяцев, результаты показали снижение средней концентрации сперматозоидов, по сравнению с плацебо, хотя эти изменения не были клинически значимыми. Это влияние не было обнаружено в исслед. приема 20 мг Тад. в течение 6 месяцев. Кроме этого, не было обнаружено негативного влияния на средние концентрации репродуктивных гормонов, тестостерона, лютеинизирующего гормона или фолликулостимулирующего гормона при приеме 10 или 20 мг Тад., по сравнению с плацебо.
Влияние на электрофизиологию сердца
Влияние однократного приема 100 мг Тад. на интервал QT был изучен во время пиковой концентрации в рандомизированном, двойном слепом, плацебо- и активно(внутривенное введение ибутилида)-контролируемом перекрестном исслед. у 90 здоровых мужчин в возрасте 18-53 года.
Среднее изменение QTc (коррекция QT по Fridericia) при приеме сиалис, по сравнению с плацебо, составило 3,5 миллисекунды (двусторонний 90% ДИ = 1,9; 5,1). Среднее изменение QTc (индивидуальная коррекция QT) при приеме тадалафила, по сравнению с плацебо, составило 2,8 миллисекунды (двусторонний 90% ДИ = 1,2; 4,4).
Доза в 100 мг (в 5 раз выше самой большой рекомендуемой дозы) была выбрана для исслед. из-за того, что эта доза дает концентрацию в плазме, перекрывающую те концентрации, которые наблюдаются при совместном применении тадалафила с сильными ингибиторами CYP3A4 или которые наблюдаются при почечной недостаточности. В этом исследовании, среднее повышение частоты сердечных сокращений, связанное с приемом 100 мг тадалафила, по сравнению с плацебо, составило 3,1 удара в минуту.
12.3 Фармакокинетика
В диапазоне доз от 2,5 до 20 мг концентрация тадалафила в плазме крови повышалась пропорционально дозе у здоровых людей. Стабильные концентрации в плазме достигались в течение 5 дней с момента начала ежедневного приема, а концентрация тадалафила примерно в 1,6 раза выше, чем после однократного приема.
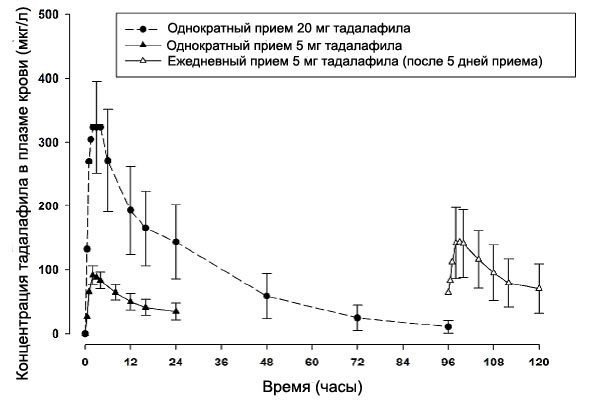
Средние концентрации тадалафила, измеренные после однократного перорального приема 20 мг, однократного приема 5 мг и ежедневного приема 5 мг в отдельном исследовании, проведенном у здоровых мужчин, изображены на Рисунке 4.
Рисунок 4. Концентрации в плазме крови после однократного приема 20 мг, однократного приема 5 мг и ежедневного приема 5 мг
Абсорбция – После однократного перорального приема максимально наблюдаемая концентрация в плазме (Cmax) достигается между 30 минутами и 6 часами (средне время составляет 2 часа). Абсолютная биодоступность после перорального приема не была определена.
Скорость и степень абсорбции не зависит от приема пищи; таким образом, может приниматься с пищей или без нее.
Распределение – Средний кажущийся объем распределения после перорального приема составляет примерно 63 л, что указывает на то, что тадалафил распределяется в ткани. В терапевтических концентрациях 94% в плазме связывается с белками.
Менее 0, 0005% принятой дозы появляется в сперме здоровых людей.
Метаболизм – преимущественно метаболизируется CYP3A4 в метаболит катехол. Метаболит катехол подвергается интенсивному метилированию и глюкуронизации с образованием метилкатехола и метилкатехолглюкуронида, соответственно. Основным циркулирующим метаболитом является метилкатехолглюкуронид. Концентрации метилкахола составляют менее 10% от концентраций глюкуронида. Данные in vitro свидетельствуют, что метаболиты не являются фармакологически активными при их наблюдаемых концентрациях.
Экскреция – Средний клиренс составляет 2,5 л/час, а средний конечный период полувыведения составляет 17,5 часов у здоровых лиц. Выводится преимущественно в виде метаболитов, в основном с калом (примерно 61% принятой дозы) и в меньшей степени – с мочой (примерно 36% от принятой дозы).
Пожилые пациенты – Здоровые пожилые мужчины (65 лет и старше) имеют более низкий клиренс Тад., что приводит к 25% росту концентрации в плазме крови (AUC) без влияния на Cmax, по сравнению со здоровыми лицами в возрасте 19-45 лет. Коррекция дозы не оправдана только на основании возраста. Однако следует учитывать повышенную чувствительность к лекарствам у некоторых пожилых людей (см. раздел Применение в отдельных группах населения (8.5)).
Дети – использование не изучалось у лиц моложе 18 лет (см. раздел Применение в отдельных группах населения (8.4)).
Пациенты с сахарным диабетом – У мужчин с сахарным диабетом поле приема 10 мг Тад. концентрация в плазме (AUC) была сниженной примерно на 19%, а Cmax была на 5% ниже, чем у здоровых людей. Коррекция дозы не требуется.
Пациенты с ДГПЖ – У пациен. с ДГПЖ после однократного и многократного приема 20 мг тадалафила не наблюдалось существенных различий в концентрации (AUC и Cmax) препарата между пожилыми (70-85 лет) и более молодыми (?60 лет) людьми. Коррекция дозы не требуется.
НЕКЛИНИЧЕСКАЯ ТОКСИКОЛОГИЯ
13.1 Канцерогенез, мутагенез, ухудшение фертильности
Канцерогенез – Тад. не был канцерогенным для крыс или мышей, когра вводился им ежедневно в течение 2 лет в дозах до 400 мг/кг/сутки. Системное воздействие препарата, измеренное по AUC несвязанного тадалафила, было примерно 10-кратным для мышей, 14- и 26-кратным для самцов и самок крыс, соответственно, по сравнению с воздействием у мужчин, принявших максимально рекомендуемую дозу человека (МРДЧ) в 20 мг.
Мутагенез – Тад. не был мутагеном в бактериальном тесте in vitro или в прямом мутационном тестировании на клетках лимфомы у мышей. Тадалафил не имел кластогенного влияния в тесте хромосомной аберрации in vitro в лимфоцитах человека или в тесте в микроядрах крыс in vivo.
Ухудшение фертильности – Не было обнаружено влияния на фертильность, репродуктивную способность или морфологию репродуктивных органов у самцов или самок крыс, получавших перорально Тад. в дозах до 400 мг/кг/сутки, при этом доза приводила к более высокой AUC несвязанного тадалафила в 14 раз для самцов или 26 раз для самок, по сравнению с наблюдаемой у мужчин, принявших МРДЧ в 20 мг.
У гончих собак, получавших Тад. ежедневно в течение от 3 до 12 месяцев, наблюдалась связанная с лечением необратимая дегенерация и атрофия эпителия семенных канальцев у 20-100% собак, что приводило к снижению сперматогенеза у 40-75% собак, принимавших дозу ?10 мг/кг/сутки. Системное воздействие (оцененное по AUC) при приеме в дозе, не вызывающей неблагоприятного влияния (10 мг/кг/сутки), для несвязанного тадалафила было сходным с ожидаемым у людей при приеме МРДЧ в 20 мг.
Изменений в яичках, связанных с лечением, у крыс или мышей, получавших дозы тадалафила до 400 мг/кг/сутки в течение 2 лет, выявлено не было.
13.2 Токсикология и / или фармакология у животных
Исследования на животных показали сосудистое воспаление у получавших тадалафил мышей, крыс и собак. У мышей и крыс наблюдались лимфоидный некроз и кровоизлияния в селезенке, тимусе и брыжеечных лимфоузлах при концентрации в плазме несвязанного Тад., которая в 2-33 раза превышала концентрацию в плазме (AUC) у людей при приеме МРДЧ в 20 мг.
У собак наблюдалась повышенная частота диссеминированного артериита в 1- и 6-месячных исслед. при концентрациях несвязанного тадалафила в плазме (AUC) в 1-54 раза превышающих концентрации (AUC) у человека при приеме МРДЧ в 20 мг.
В 12-месячном исследовании на собаках диссеминированный артериит не наблюдался, но у 2 собак наблюдалось заметное снижение количества лейкоцитов и умеренное уменьшение количества тромбоцитов с признаками воспаления при концентрации несвязанного Тад. (AUC) примерно в 14-18 раз выше, чем концентрации у людей при приеме МРДЧ в 20 мг. После прекращения лечения патологические изменения кровяных клеток исчезли в течение 2 недель.
Клинические исследования
14.1 Применение по мере необходимости при эректильной дисфункции
Эффективность и безопасность тадалафила в лечении эректильной дисфункции была изучена в 22 клинических исслед. длительностью до 22 недель, включающих более 4000 пациентов. При приеме по мере необходимости до одного раза в сутки продемонстрировал эффективность в улучшении эректильной функции у мужчин с эректильной дисфункцией (ЭД).
Он был изучен в общей популяции с ЭД в 7 рандомизированных, мультицентровых, двойных слепых, плацебо-контролируемых исследованиях первичной эффективности и безопасности длительностью в 12 недель. Два из этих исслед. были проведены в США, а 5 – в центрах за пределами США. Дополнительно исслед. эффективности и безопасности были проведены у пациентов с ЭД и сахарным диабетом, а также у пациен., у которых ЭД развилась после двусторонней радикальной простатэктомии.
В этих 7 исследованиях он принимался по мере необходимости в дозе от 2,5 до 20 мг до одного раза в день. Пациенты могли свободно выбирать временной интервал между приемом препарата и временем сексуальной активности. Прием пищи или алкоголя не ограничивался.
Для оценки влияния СИАЛИСА на эректильную функцию использовались несколько оценочных инструментов. Тремя основными критериями оценки были подраздел Эректильная Функция (ЭФ) в Международном Индексе Эректильной Функции (МИЭФ), 2-й и 3-й вопросы из Дневника Сексуальных Отношений (Sexual Encounter Profile — SEP). МИЭФ представляет собой 4-недельный опрос, который проводится в конце базового периода без лечения, а затем на последующих визитах после рандомизации.
Подраздел ЭФ МИЭФ имеет 30-бальную шкалу, в которой большая оценка отражает лучшую эректильную функцию. SEP – это дневник, в котором пациенты фиксировали каждую сексуальную попытку, совершенную в течение всего исслед.. Второй вопрос SEP спрашивает: «Смогли ли Вы ввести свой пенис внутрь влагалища партнера?». Третий вопрос SEP спрашивает: «Ваша эрекция длилась достаточно долго, чтобы Вы могли успешно завершить половой акт?». У каждого пациента определялся общий процент успешных попыток введения пениса во влагалище (SEP2) и поддержания эрекции для успешного полового акта (SEP3).
Результаты у людей с ЭД в исследованиях в США – В двух первичных исслед. эффективности и безопасности в США принимало участие 402 мужчины с эректильной дисфункцией, со средним возрастом 59 лет (в диапазоне от 27 до 87 лет). 78% участников были белокожими, 14% — чернокожими, 7% — латиноамериканцами, 1% — других национальностей, они включали пациен. с эректильной дисфункцией различной тяжести, этиологии (органической, психогенной, смешанной) и с различными сопутствующими заболеваниями, включая сахарный диабет, артериальную гипертензию и другие сердечно-сосудистые болезни.
Большинство (>90%) пациентов сообщили об ЭД длительностью, как минимум, 1 год. Исследование А проводилось в основном в академических центрах. Исслед.B проводилось в основном урологических клиниках. В каждом из этих двух исслед. 20 мг СИАЛИСА продемонстрировали клинически и статистически значимое улучшение во всех трех первичных критериях оценки (см. Таблицу 11). Лечебный эффект не уменьшался со временем.
Таблица 11. Средняя конечная точка и изменение от исходных значений в первичных критериях оценки в двух исслед. в США
| Исследование А | Исследование В | |||||
| Плацебо | СИАЛИС 20мг | Плацебо | СИАЛИС 20мг | |||
| (N=49) | (N=146) | p-значение | (N=48) | (N=159) | ||
| Оценка по разделу ЭФ | ||||||
| Конечная точка | 13,5 | 19,5 | 13,6 | 22,5 | ||
| Изменение от исходного уровня | -0,2 | 6,9 | <0,001 | 0,3 | 9,3 | <0,001 |
| Введение пениса (SEP2) | ||||||
| Конечная точка | 39% | 62% | 43% | 77% | ||
| Изменение от исходного уровня | 2% | 26% | <0,001 | 2% | 32% | <0,001 |
| Поддержание эрекции (SEP3) | ||||||
| Конечная точка | 25% | 50% | 23% | 64% | ||
| Изменение от исходного уровня | 5% | 34% | <0,001 | 4% | 44% | <0,001 |
Результаты у людей с ЭД в исследованиях за пределами США. Пять первичных исслед. эффективности и безопасности, проведенные за пределами США, включали 1112 участников со средним возрастом 59 лет (от 21 до 82 лет).
Участники в 76% были белокожими, 1% — чернокожими, 3% — латиноамериканцами, 20% — имели другую национальность, они включали пациентов с ЭД различной тяжести, этиологии (органической, психогенной, смешанной) и с различными сопутствующими заболеваниями, включая сахарный диабет, артериальную гипертензию и другие сердечно-сосудистые болезни. Большинство (>90%) пациен. сообщили об ЭД длительностью, как минимум, 1 год.
В каждом из этих пяти исследований 5, 10 и 20 мг СИАЛИС продемонстрировали клинически и статистически значимое улучшение во всех трех первичных критериях оценки (см. Таблицы 12, 13 и 14). Лечебный эффект не уменьшался со временем.
Таблица 12. Средняя конечная точка и изменение от исходных значений для раздела ЭФ МИЭФ у людей с ЭД в пяти первичных исслед. за пределами США
| Плацебо | 5 мг | 10 мг | 20 мг | |
| Исследование С | ||||
| Конечная точка (Изменение от исходных значений) | 15,0 (0,7) | 17,9 (4,0) | 20,0 (5,6) | |
| p=0,006 | p<0,001 | |||
| Исследование D | ||||
| Конечная точка (Изменение от исходных значений) | 14,4 (1,1) | 17,5 (5,1) | 20,6 (6,0) | |
| p=0,002 | p<0,001 | |||
| Исследование E | ||||
| Конечная точка (Изменение от исходных значений) | 18,1 (2,6) | 22,6 (8,1) | 25,0 (8,0) | |
| p<0,001 | p<0,001 | |||
| Исследование Fa | ||||
| Конечная точка (Изменение от исходных значений) | 12,7 (-1,6) | 22,8 (6,8) | ||
| p<0,001 | ||||
| Исследование G | ||||
| Конечная точка (Изменение от исходных значений) | 14,5 (-0,9) | 21,2 (6,6) | 23,3 (8,0) | |
| p<0,001 | p<0,001 | |||
а – Длительность лечения в исследовании F составила 6 месяцев
Таблица 13. Среднее значение показателя успешности и его изменение по сравнению с исходным уровнем для вопроса 2 SEP («Смогли ли Вы ввести свой пенис внутрь влагалища партнера?») у мужчин с ЭД в пяти основных исслед. за пределами США
| Плацебо | 5 мг | 10 мг | 20 мг | |
| Исследование С | ||||
| Конечная точка (Изменение от исходных значений) | 49% (6%) | 57% (15%) | 73% (29%) | |
| p=0,063 | p<0,001 | |||
| Исследование D | ||||
| Конечная точка (Изменение от исходных значений) | 46% (2%) | 56% (18%) | 68% (15%) | |
| p=0,008 | p<0,001 | |||
| Исследование E | ||||
| Конечная точка (Изменение от исходных значений) | 55% (10%) | 77% (35%) | 85% (35%) | |
| p<0,001 | p<0,001 | |||
| Исследование Fa | ||||
| Конечная точка (Изменение от исходных значений) | 42% (-8%) | 81% (27%) | ||
| p<0,001 | ||||
| Исследование G | ||||
| Конечная точка (Изменение от исходных значений) | 45% (-6%) | 73% (21%) | 76% (21%) | |
| p<0,001 | p<0,001 | |||
а – Длительность лечения в исследовании F составила 6 месяцев
Таблица 14. Среднее значение показателя успешности и его изменение по сравнению с исходным уровнем для вопроса 3 SEP («Ваша эрекция длилась достаточно долго, чтобы Вы могли успешно завершить половой акт?») у мужчин с ЭД в пяти основных исслед. за пределами США
| Плацебо | 5 мг | 10 мг | 20 мг | |
| Исследование С | ||||
| Конечная точка (Изменение от исходных значений) | 26% (4%) | 38% (19%) | 58% (32%) | |
| p=0,040 | p<0,001 | |||
| Исследование D | ||||
| Конечная точка (Изменение от исходных значений) | 28% (4%) | 42% (24%) | 51% (26%) | |
| p=0,001 | p<0,001 | |||
| Исследование E | ||||
| Конечная точка (Изменение от исходных значений) | 43% (15%) | 70% (48%) | 18% (50%) | |
| p<0,001 | p<0,001 | |||
| Исследование Fa | ||||
| Конечная точка (Изменение от исходных значений) | 27% (1%) | 74% (40%) | ||
| p<0,001 | ||||
| Исследование G | ||||
| Конечная точка (Изменение от исходных значений) | 32% (5%) | 57% (33%) | 62% (29%) | |
| p<0,001 | p<0,001 | |||
а – Длительность лечения в исследовании F составила 6 месяцев
Кроме этого, наблюдалось улучшение показателей в разделе ЭФ МИЭФ, показателей успеха, оцениваемых по вопросах 2 и 3 SEP, а также улучшение эрекции у пациентов с ЭД всех степеней тяжести при приеме СИАЛИСА, по сравнению с плацебо.
Таким образом, во всех 7 первичных исследованиях эффективности и безопасности продемонстрировал статистически значимое улучшение способности пациен. достигать достаточной эрекции для проникновения во влагалище и поддерживать достаточную эрекцию в течение достаточного времени для совершения успешного полового акта, что оценивалось по опроснику МИЭФ и дневнику SEP.
Результаты исследований эффективности у пациентов с ЭД, больных сахарным диабетом – продемонстрировал эффективность в лечении ЭД у пациен. с сахарным диабетом. Пациенты с диабетом были включены во все 7 первичных исслед. эффективности (N=235) и в одно исследование, которое специфически оценивало у пациен. с ЭД, имеющих сахарный диабет 1 или 2 типа (N=215). В этом рандомизированном, плацебо-контролируемом, двойном слепом, проспективном исслед. с параллельным дизайном СИАЛИС продемонстрировал клинически и статистически значимое улучшение эректильной функции, что оценивалось по разделу ЭФ опросника МИЭФ и по вопросам 2,3 дневника SEP (см. Талицу 15).
Таблица 15. Средняя конечная точка и изменение от исходных значений в первичных критериях оценки в исслед. у пациен. с ЭД, имеющих сахарный диабет
| Плацебо | 10мг | 20мг | |||
| (N=49) | (N=146) | (N=159) | p-значение | ||
| Оценка по разделу ЭФ | |||||
| Конечная точка (Изменение от исходных значений) | 12,2 (0,1) | 19,3 (6,4) | 18,7 (7,3) | p<0,001 | |
| Введение пениса (SEP2) | |||||
| Конечная точка (Изменение от исходных значений) | 30% (-4%) | 57% (22%) | 54% (23%) | p<0,001 | |
| Поддержание эрекции (SEP3) | |||||
| Конечная точка (Изменение от исходных значений) | 20% (2%) | 48% (28%) | 42% (29%) | p<0,001 | |
Результаты эффективности у пациентов с ЭД после радикальной простатэктомии – СИАЛИС продемонстрировал свою эффективность в лечении пациен., у которых ЭД развилась после двусторонней радикальной простатэктомии с сохранением нервов. В 1 рандомизированном, плацебо-контролируемом, двойном слепом, проспективном исследовании с параллельным дизайном у этой группы пациен. (N=303) препарат продемонстрировал клинически и статистически значимое улучшение эректильной функции, что оценивалось по разделу ЭФ в опроснике МИЭФ, а также по вопросах 2 и 3 в дневнике SEP (см. Таблицу 16).
Таблица 16. Средняя конечная точка и изменение от исходных значений в первичных критериях оценки в исследовании у пациентов, у которых ЭД развилась после двусторонней радикальной простатэктомии с сохранением нервов
| Плацебо | 20мг | ||
| (N=102) | (N=201) | p-значение | |
| Оценка по разделу ЭФ | |||
| Конечная точка (Изменение от исходных значений) | 13,3 (1,1) | 17,7 (5,3) | p<0,001 |
| Введение пениса (SEP2) | |||
| Конечная точка (Изменение от исходных значений) | 32% (2%) | 54% (22%) | p<0,001 |
| Поддержание эрекции (SEP3) | |||
| Конечная точка (Изменение от исходных значений) | 19% (4%) | 41% (23%) | p<0,001 |
Результаты исследований по определению оптимального применения – С целью определения оптимального использования для лечения ЭД были проведены несколько научных исслед.. В одном из этих исслед. был определен процент пациентов, сообщавших об успешных эрекциях в течение 30 минут после приема дозы препарата.
В этом рандомизированном, плацебо-контролируемом, двойном слепом исслед. 223 пациенты были рандомизированы в группы плацебо, 10 или 20 мг.
Используя секундомер, они записывали время, которое проходило от приема лекарства до достижения успешной эрекции. Успехом считалось, как минимум, 1 эрекция из 4 попыток, которая привела к успешному половому акту. В течение или до 30 минут, в группах плацебо, 10 и 20 мг об успешной эрекции сообщили, соответственно, 35% (26/74), 38% (28/74) и 52% (39/75) пациентов.
Для оценки эффективности в определенный момент времени, после его приема (в частности, через 24 и 36 часов после приема) были проведены 2 исследования.
В первом из этих исслед., в группы плацебо или СИАЛИСА были рандомизированы 348 пациентов с ЭД. Пациентам было предложено совершить 4 полных попытки полового акта; 2 попытки должны были быть проведены через 24 часа после приема, еще 2 – через 36 часов. Результаты продемонстрировали различия между группами плацебо и препарата в каждой из заранее определенных временных точек. Через 24 часа (более конкретно, от 22 до 26 часов), 37% (53/144) пациентов из группы плацебо сообщили об, как минимум, 1 успешном половом акте, по сравнению с 61% (84/138) пациен. в группе 20 мг.
Через 36 часов (более конкретно, от 33 до 39 часов), 37% (49/133) пациентов из группы плацебо сообщили об, как минимум, 1 успешном половом акте, по сравнению с 64% (88/137) пациен. в группе 20 мг.
Во втором из этих исследований в общей сложности 483 пациентов были равномерно рандомизированы в 1 из 6 групп: 3 группы различного приема (плацебо, 10 или 20 мг СИАЛИС), которых инструктировали попытаться совершить половой акт в два разных временных отрезка (24 и 36 часов после приема средства). Пациен. предлагалось 4 отдельных попытки после назначенного приема средства и в назначенное время.
В этом исслед. результаты продемонстрировали статистически значимую разницу между группами плацебо и Cialis в каждой из заранее определенных временных точек. Через 24 часа среднее количество успешных попыток совершения полового акта на одного пациента в группах плацебо, 10 или 20 мг составляло, соответственно, 42%, 56% и 67%. Через 36 часов среднее количество успешных попыток совершения полового акта на одного пациента в группах плацебо, 10 или 20 мг средства составляло, соответственно, 33%, 56% и 62%.
14.2 Ежедневное применение для лечения ЭД
Безопасность и эффективность ежедневного применения СИАЛИСА для лечения эректильной дисфункции были оценены в 2 клинических исследованиях длительностью 12 недель и в 1 клиническом исслед. длительностью 24 недели, включающих в общем числе 853 пациента. При однократном ежедневном приеме продемонстрировал эффективность в улучшении эректильной функции у мужчин с эректильной дисфункцией (ЭД).
СИАЛИС изучался у людей с ЭД в 2 рандомизированных, мультицентровых, двойных слепых, плацебо-контролируемых исследованиях эффективности и безопасности длительностью 12 и 24 недель. Одно из этих исслед. было проведено в США, а другое – в центрах за пределами США. Кроме этого, было проведено исслед. эффективности и безопасности у пациентов с ЭД и с сахарным диабетом. Препарат принимался один раз в день в дозе от 2,5 до 10 мг. Прием пищи и употребление алкоголя не ограничивалось. Время сексуальной активности по отношению к времени приема не ограничивалось.
Результаты в общей популяции с ЭД – Первичное исследование безопасности и эффективности в США включало в общем 287 пациентов со средним возрастом 59 лет (диапазон от 25 до 82 лет). Участники в 86% были белокожими, 6% — чернокожими, 6% — латиноамериканцами, 2% — имели другую национальность, они включали пациен. с ЭД различной тяжести, этиологии (органической, психогенной, смешанной) и с различными сопутствующими заболеваниями, включая сахарный диабет, артериальную гипертензию и другие сердечно-сосудистые болезни. Большинство (>96%) пациен.сообщили об ЭД длительностью, как минимум, 1 год.
Первичное исслед. безопасности и эффективности, поведенное за пределами США, включало в общем 268 пациен. со средним возрастом 56 лет (диапазон от 21 до 78 лет). Участники в 86% были белокожими, 3% — чернокожими, 0,4% — латиноамериканцами, 10% — имели другую национальность, они включали пациентов с ЭД различной тяжести, этиологии (органической, психогенной, смешанной) и с различными сопутствующими заболеваниями, включая сахарный диабет, артериальную гипертензию и другие сердечно-сосудистые болезни. 93% пациентов сообщили об ЭД длительностью, как минимум, 1 год.
В каждом из этих исслед., проведенных без учета времени приема средства и полового акта, СИАЛИС продемонстрировал клинически и статистически значимое улучшение эректильной функции, что оценивалось по разделу ЭФ в опроснике МИЭФ, а также по вопросах 2 и 3 в дневнике SEP (см. Таблицу 17). При приеме по назначению СИАЛИС эффективно улучшал эректильную функцию.
В 6-месячном двойном слепом исслед. лечебный эффект лекарства не уменьшался со временем.
Таблица 17. Средняя конечная точка и изменение от исходных значений в первичных критериях оценки в двух исследованиях ежедневного применения
| Исследование Ha | Исследование Ib | ||||||
| Плацебо | 2,5мг | 5мг | Плацебо | 5мг | |||
| (N=94) | (N=96) | (N=97) | p-значение | (N=54) | (N=109) | p-значение | |
| Оценка по разделу ЭФ | |||||||
| Конечная точка | 14,6 | 19,1 | 20.8 | 15,0 | 22,8 | ||
| Изменение от исходного уровня | 1,2 | 6,1с | 7,0с | <0,001 | 0,9 | 9,7с | <0,001 |
| Введение пениса (SEP2) | |||||||
| Конечная точка | 51% | 65% | 71% | 52% | 79% | ||
| Изменение от исходного уровня | 5% | 24% | 26%с | <0,001 | 11% | 37%с | <0,001 |
| Поддержание эрекции (SEP3) | |||||||
| Конечная точка | 31% | 50% | 57% | 37% | 67% | ||
| Изменение от исходного уровня | 10% | 31%с | 35%с | <0,001 | 13% | 46%с | <0,001 |
а – 24-недельное исследование, проведенное в США.
b – 12-недельное исслед., проведенное за пределами США.
c – статистически значимая разница по сравнению с плацебо.
Результаты исследований эффективности у пациентов с ЭД, больных сахарным диабетом – Ежедневное применение продемонстрировало эффективность в лечении ЭД у пациен. с сахарным диабетом. Пациенты с диабетом были включены в оба исслед., проведенные в общей популяции с ЭД (N=79). Третье рандомизированное, мультицентровое, двойное слепое, плацебо-контролируемое исслед. включало только пациен. с ЭД с сахарным диабетом 1 или 2 типа (N=298). В этом третьем исследовании СИАЛИС продемонстрировал клинически и статистически значимое улучшение в эректильной функции, что оценивалось по разделу ЭФ в опроснике МИЭФ, а также по вопросах 2 и 3 в дневнике SEP (см. Таблицу 18).
Таблица 18. Средняя конечная точка и изменение от исходных значений в первичных критериях оценки в исслед.ежедневного применения у пациен. с ЭД с сахарным диабетом
| Плацебо | 2,5мг | 5мг | ||
| (N=100) | (N=100) | (N=98) | p-значение | |
| Оценка по разделу ЭФ | ||||
| Конечная точка | 14,7 | 18,3 | 17,2 | |
| Изменение от исходного уровня | 1,3 | 4,8a | 4,5a | <0,001 |
| Введение пениса (SEP2) | ||||
| Конечная точка | 43% | 62% | 61% | |
| Изменение от исходного уровня | 5% | 21%а | 29%а | <0,001 |
| Поддержание эрекции (SEP3) | ||||
| Конечная точка | 28% | 46% | 41% | |
| Изменение от исходного уровня | 8% | 26%а | 25%а | <0,001 |
а – статистически значимая разница по сравнению с плацебо.
14.3 Ежедневное применение 5 мг СИАЛИСА для лечения доброкачественной гиперплазии предстательной железы (ДГПЖ)
Эффективность и безопасность ежедневного применения для лечения признаков и симптомов ДГПЖ были оценены в 3 рандомизированных, многонациональных, двойных слепых, плацебо-контролируемых исследованиях эффективности и безопасности с параллельным дизайном длительностью 12 недель.
Два из этих исследований были проведены у мужчин с ДГПЖ, а одно – у мужчин с ЭД и ДГПЖ (см. раздел Клинические исслед.(14.4)). Первое исследование (исслед. J) рандомизировало 1058 пациен. в группы ежедневного применения СИАЛИС в дозах 2,5 мг, 5 мг, 10 мг или 20 мг или в группу плацебо.
Второе исследование (исслед. K) рандомизировало 1325 пациентов в группу ежедневного применения тадалафила в дозе 5 мг или в группу плацебо. В целом, участники в 87% были белокожими, 2% — чернокожими, 15% — латиноамериканцами, 11% — имели другую национальность.
Также в исслед. были включены пациен. с различными сопутствующими заболеваниями, включая сахарный диабет, артериальную гипертензию и другие сердечно-сосудистые болезни.
Первичной конечной точкой эффективности в двух исслед., которые оценивали влияние на признаки и симптомы ДГПЖ, была оценка по Международной системе суммарной оценки заболеваний предстательной железы (IPSS), которая проводилась в начале и конце приема плацебо, а затем при повторных визитах после рандомизации.
IPSS оценивает тяжесть раздражительных (частота, срочность, никтурия) и обструктивных (неполное опорожнение, слабая струя мочи, натуживание, перерывчатость мочеиспускания) симптомов по шкале от 0 до 35; более высокая оценка представляет собой большую степень тяжести болезни.
Максимальная скорость потока мочи (Qmax) – объективная оценка потока мочи – оценивалась в качестве вторичной конечной точки эффективности в исслед. J и в качестве конечной точки безопасности в исследовании K.
Результаты у пациен. с ДГПЖ с умеренными и тяжелыми симптомыми и средним возрастом 63,2 года (от 44 до 87 лет), получавших либо СИАЛИС 5 мг ежедневно либо плацебо (N=748), в исслед. J и K, показаны в Таблице 19 и рисунках 5 и 6, соответственно.
Таблица 19. Средние изменения оценки по IPSS у пациентов с ДГПЖ в двух исследованиях ежедневного применения
| Исследование J | Исследование K | |||||
| Плацебо | 5мг | Плацебо | 5мг | |||
| (N=205) | (N=205) | p-значение | (N=164) | (N=160) | p-значение | |
| Общая оценка по IPSS | ||||||
| Исходный уровень | 17,1 | 17,3 | 16,6 | 17,1 | ||
| Изменение от исходного уровня через 12 недель | -2,2 | -4,8 | <0,001 | -3,6 | -5,6 | <0,001 |
В исследовании J влияние ежедневного применения 5 мг на максимальную скорость потока мочи (Qmax) оценивалась в качестве вторичной конечной точки эффективности. Среднее значение Qmax увеличивалось, по сравнению с исходным уровнем, как в групп лечения, так и в группе плацебо (СИАЛИС 5мг – 1,6 мл/с; плацебо – 1,2 мл/с); однако эти изменения не имели значимых различий между группами.
В исследовании K влияние ежедневного применения 5 мг на Qmax оценивалась в качестве конечной точки безопасности. Среднее значение Qmax увеличивалось, по сравнению с исходным уровнем, как в группе лечения, так и в группе плацебо (СИАЛИС 5мг – 1,6 мл/с; плацебо – 1,1 мл/с); однако эти изменения не имели значимых различий между группами.
Результаты эффективности у пациентов с ДГПЖ, начавших лечение СИАЛИСОМ и финастеридом – Ежедневное применение, начавшееся вместе с финастеридом, продемонстрировало эффективность в лечении признаков и симптомов ДГПЖ у мужчин с увеличенной предстательной железой (> 30 см3) в течение до 26 недель.
Это дополнительное, двойное слепое исслед. с параллельным дизайном длительностью 26 недель рандомизировало 696 мужчин либо в группу начала лечения 5 мг СИАЛИСА с 5 мг финастерида, либо в группу с плацебо и 5 мг финастерида. Средний возраст участников составлял 64 года (46-86 лет). Также в исследование были включены пациенты с различными сопутствующими заболеваниями, включая эректильную дисфункцию, сахарный диабет, артериальную гипертензию и другие сердечно-сосудистые болезни.
Комбинация с финастеридом продемонстрировала статистически значимое улучшение в симптомах и признаках ДГПЖ, по сравнению с комбинацией плацебо и финастерида, что оценивалось суммарной оценкой по IPSS через 12 недель – первичная конечная точка исслед. (см. Таблицу 20). Ключевые вторичные конечные точки продемонстрировали улучшение общей оценки по IPSS, начиная с первого запланированного наблюдения на 4-й неделе (СИАЛИС -4,0; плацебо -2,3; p<0,001), и оценка оставалась сниженной через 26 недель (СИАЛИС -5,5; плацебо -4,5; p<0,022). Однако величина разницы в лечении между комбинацией плацебо/финастерид и комбинацией СИАЛИС/финастерид снизилась от 1,7 пункта на 4-й неделе до 1,0 пункта на 26-й неделе, что показано в Таблице 20 и Рисунке 7. Дополнительные преимущества тадалафила после 26 недель неизвестны.
Таблица 20. Средние изменения общей оценки по IPSS у пациентов с ДГПЖ в исследовании ежедневного применения вместе с финастеридом
| Плацебо и финастерид 5мг | 5мг и финастерид 5 мг | Лечебная разница | ||||
| n | (N=350)a | n | (N=345)a | p-значениеb | ||
| Общая оценка по IPSS | ||||||
| Исходный уровеньc | 349 | 17,4 | 344 | 17,1 | ||
| Изменения от исходного уровня на 4-й неделеb | 340 | -2,3 | 330 | -4,0 | -1,7 | <0,001 |
| Изменения от исходного уровня на 12-й неделеb | 318 | -3,8 | 317 | -5,2 | -1,4 | 0,001 |
| Изменения от исходного уровня на 26-й неделеb | 295 | -4,5 | 309 | -5,5 | -1,0 | 0,022 |
a – Общая численность участников, начавших исследование
b – смешанная модель для повторных измерений
c – нескорректированное среднее значение
У 404 пациентов, изначально имевших и ЭД, и ДГПЖ, изменения эректильной функции оценивалось в качестве ключевой вторичной конечной точки с помощью раздела ЭФ в опроснике МИЭФ. Комбинация средства с финастеридом (N=203) сравнивалась с комбинацией плацебо с финастеридом (N=201).
Статистически значимое улучшение, по сравнению с исходным уровнем (СИАЛИС/финастерид 13,7; плацебо/финастерид 15,1) наблюдалось на 4-й неделе (СИАЛИС/финастерид 3,7; плацебо/финастерид -1,1; p<0,001), 12-й неделе (СИАЛИС/финастерид 4,7; плацебо/финастерид 0,6; p<0,001) и 26-й неделе ((СИАЛИС/финастерид 4,7; плацебо/финастерид 0,0; p<0,001).
14.4 Ежедневное применение 5 мг лекарства для лечения ЭД и ДГПЖ
Эффективность и безопасность ежедневного применения СИАЛИСА для лечения ЭД, а также признаков и симптомов ДГПЖ у пациентов с двумя этими заболеваниями, были изучены в одном плацебо-контролируемом, многонациональном, двойном слепом исследовании, которое рандомизировало 606 пациентов либо в группы ежедневного применения 2,5 или 5 мг, либо в группу плацебо. Тяжесть ЭД варьировалась от легкой до тяжелой, а тяжесть ДГПЖ – от умеренной до тяжелой. Средний возраст всех участников был 63 года (от 45 до 83 лет), из них 93% были белокожими, 4% — чернокожими, 16% — латиноамериканцами, 3% — имели другую национальность. Также в исслед. были включены пациенты с различными сопутствующими заболеваниями, включая сахарный диабет, артериальную гипертензию и другие сердечно-сосудистые болезни.
В этом исследовании совместными конечными точками были общая оценка по IPSS и оценка по разделу ЭФ в опроснике МИЭФ. Одной из ключевых вторичных конечных точек в этом исслед. был вопрос 3 в SEP. Время сексуальной активности не ограничивалось относительно того, когда пациент принимал СИАЛИС.
Результаты эффективности для пациентов, имеющих и ЭД, и ДГПЖ, получавших либо 5 мг СИАЛИС ежедневно, либо плацебо (N=408), показаны в Таблицах 21 и 22, и в Рисунке 8.
Ежедневное использование 5 мг СИАЛИСА приводило к статистически значимым улучшениям общей оценки по IPSS и по разделу ЭФ в опроснике МИЭФ. Ежедневное применение 5 мг средства также привело к статистически значимому улучшению в SEP3. Употребление в дозе 2,5 мг не приводило к статистически значимому улучшению общей оценки по IPSS.
Таблица 21. Средние изменения общей оценки по IPSS и по разделу ЭФ в опроснике МИЭФ в исследовании ежедневного применения 5 мг СИАЛИСА у пациентов с ЭД и ДГПЖ
| Плацебо | 5мг | p-значение | |
| Общая оценка по IPSS | |||
| (N=193) | (N=206) | ||
| Исходный уровень | 18,2 | 18,5 | |
| Изменения от исходного уровня на 12-й неделе | -3,8 | -6,1 | <0,001 |
| Оценка по разделу ЭФ опросника МИЭФ | |||
| (N=188) | (N=202) | ||
| Исходный уровень | 15,6 | 16,5 | |
| Конечная точка | 17,6 | 22,9 | |
| Изменения от исходного уровня на 12-й неделе | 1,9 | 6,5 | <0,001 |
Таблица 22: Средние изменения в вопросе 3 SEP в исследовании ежедневного применения 5 мг у пациентов с ЭД и ДГПЖ
| Плацебо | 5мг | ||
| (N=187) | (N=199) | p-значение | |
| Поддержание эрекции (SEP3) | |||
| Исходный уровень | 36% | 43% | |
| Конечная точка | 48% | 72% | |
| Изменения от исходного уровня на 12-й неделе | 12% | 32% | <0,001 |
Ежедневное применение привело к улучшению общей оценки по IPSS при первом запланированном наблюдении (2 неделя) и в течение 12 недель лечения (см. Рисунок 8).
В этом исследовании влияние ежедневного употребления 5 мг СИАЛИС на Qmax было оценено в качестве конечной точки безопасности. Среднее значение Qmax увеличивалось, по сравнению с исходным уровнем, как в группе лечения, так и в группе плацебо (СИАЛИС 5мг – 1,6 мл/с; плацебо – 1,2 мл/с); эти изменения не имели значимых различий между группами.
КАК ПОСТАВЛЯЕТСЯ И ХРАНИТСЯ
16.1 Как поставляется
Поставляется в следующем виде
Миндалевидные таблетки, имеющие четыре дозировки, имеющие различные размеры и различные оттенки желтого цвета, поставляются в следующих размерах упаковки:
- Таблетки 2,5 мг с надписью «C 2 1/2» в блистерах 2 х 15
- Таблетки 5 мг с надписью «C 5» в блистерах 2 х 15 или в бутылочках по 30
- Таблетки 10 мг с надписью «C 10» в бутылочках по 30
- Таблетки 20 мг с надписью «C 20» в бутылочках по 30
16.2 Хранение
Хранить при 25°C; разрешенный диапазон 15-30°C. Хранить в недоступном для детей месте.
Информация для консультирования пациентов
17.1 Нитраты
Врачи должны обсудить с пациентами противопоказания к применению препарата с регулярным и/или периодическим использованием органических нитратов. Пациенты должны быть проконсультированы, что сочетанное использование с нитратами может вызвать внезапное падение артериального давления до небезопасного уровня, приводя к головокружению, синкопальным состояниям и даже к сердечному приступу или инсульту.
Врачи должны обсудить с пациентами соответствующие действия в случае, если они испытывают стенокардитическую боль в грудной клетке, требующую приема нитратов после тадалафила. У такого пациента, который принимал СИАЛИС, когда введение нитратов считается медицински необходимым в опасных для жизни ситуациях, должно пройти, как минимум, 48 часов после приема последней дозы препарата перед введением нитрата.
В таких обстоятельствах нитраты должны вводится под тщательным медицинским наблюдением с соответствующим контролем гемодинамики. Таким образом, пациенты, испытывающие стенокардитическую боль в грудной клетке после приема, должны немедленно обратиться за медицинской помощью (см. разделы Противопоказания (4.1) и Предупреждения и меры предосторожности(5.1)).
17.2 Стимуляторы гуанилатциклазы
Врачи должны обсудить с пациентами противопоказание к применению тадалафила при любом использовании стимулятора гуанилатциклазы, такого как риоцигуат, для лечения артериальной гипертензии. Пациентов нужно консультировать, что совместное использование СИАЛИСА со стимуляторами гуанилатциклазы может вызвать опасное падение артериального давления.
17.3 Сердечнососудистые особенности
Врачи должны учитывать потенциальный сердечный риск сексуальной активности у пациентов с уже существующими сердечно-сосудистыми заболеваниями. Врачи должны советовать пациентам, у которых появились симптомы после начала сексуальной активности, воздержаться от дальнейшей сексуальной активности и немедленно обратиться за медицинской помощью (см. раздел Предупреждения и меры предосторожности(5.1)).
17.4 Совместное использование с препаратами, снижающими артериальное давление
Врачи должны обсудить с пациентами возможности тадалафила усиливать гипотензивные эффекты альфа-блокаторов и антигипертензивных препаратов (см. разделы Предупреждения и меры предосторожности(5.6) и Клиническая фармакология (12.2)).
17.5 Возможность лекарственных взаимодействий при ежедневном применении
Врачи должны обсудить с пациентами клинические последствия длительного воздействия тадалафила при назначении ежедневного употребления, особенно возможность взаимодействий с лекарствами (например, с нитратами, альфа-блокаторами, антигипертензивными препаратами, сильными ингибиторами цитохрома P450 3A4) и со значительным употреблением алкоголя (см. 2.7, 5.6, 7.1, 7.2, 12.2 и 14.2).
17.6 Приапизм
Имеются редкие сообщения о длительной эрекции более 4 часов и приапизме (болезненная эрекция длительностью более 6 часов) для этого класса лекарств. Приапизм, если его немедленно не начать лечить, может привести к необратимому повреждению эректильной ткани. Врачи должны рекомендовать пациентам, эрекция у которых длится более 4 часов, независимо от того, болезненная она или нет, немедленно обращаться за медицинской помощью.
17.7 Внезапная потеря зрения
Врачи должны рекомендовать пациентам прекратить употребление любого ингибитора ФДЭ5, включая СИАЛИС, и немедленно обращаться за медицинской помощью в случае внезапной потери зрения на один или оба глаза. Такое событие может быть признаком неартериитической передней ишемической невропатии зрительного нерва (НПИНЗН)– причины ухудшения зрения, включая его постоянную полную потерю, о котором были редкие постмаркетинговые сообщения во временной ассоциации с применением всех ингибиторов ФДЭ5.
Врачи должны обсудить с пациентами повышенный риск НПИНЗН у людей, которые уже имели НПИНЗН в одном глазу. Врачи также должны обсудить с пациентами повышенный риск НПИНЗН у пациентов с отеком диска зрительного нерва, хотя доказательств для поддержки проведения скрининга этого редкого заболевания у предполагаемых пользователей ингибиторов ФДЭ5 недостаточно (см. разделы Предупреждения и меры предосторожности(5.4) и Побочные реакции (6.2)).
17.8 Внезапная потеря слуха
Врачи должны рекомендовать пациентам прекратить употребление любого ингибитора ФДЭ5, и немедленно обращаться за медицинской помощью в случае внезапного ухудшения или потери слуха. Об этих событиях, которые могут сопровождаться шумом в ушах и головокружением, были сообщения во временной ассоциации с применением всех ингибиторов ФДЭ5. Определить, связаны ли эти события напрямую с тадалафилом или с другими факторами, невозможно (см. раздел Побочные реакции (6.1, 6.2)).
17.9 Алкоголь
Пациентам следует сообщить, что алкоголь и ингибитор ФДЭ5 — являются слабыми вазодилататорами. Когда слабые вазодилататоры принимаются в комбинации, гипотензивные эффекты каждого из них могут усиливаться.
Таким образом, врачи должны информировать пациентов, что существенное потребление алкоголя (например, 5 стандартных доз или больше) в сочетании с приемом препарат может увеличить вероятность ортостатических симптомов и признаков, включая повышение частоты сердечных сокращений, снижение артериального давления в вертикальном положении, головокружение и головную боль см. разделы Предупреждения и меры предосторожности(5.9), Взаимодействие с другими лекарствами (7.1) и Клиническая фармакология (12.2)).
17.10 Болезни, передающиеся половым путем
Его использование не защищает от заболеваний, передающихся половым путем. Необходимо проводить консультирование пациентов о мерах по защите от заболеваний, передающихся половым путем, включая вирус иммунодефицита человека (ВИЧ).
17.11 Рекомендуемое применение
Врачи должны инструктировать пациентов о правильном употреблении для обеспечения оптимального использования.
При применении по мере необходимости мужчинами с ЭД, пациентов нужно инструктировать принимать 1 таблетку как минимум за 30 минут до ожидаемой сексуальной активности. У большинства пациентов способность к осуществлению полового акта до 36 часов.
При ежедневном употреблении для лечения ЭД или ЭД/ДГПЖ, пациентов нужно инструктировать принимать одну таблетку примерно в одно и то же время каждый день без учета времени сексуальной активности. СИАЛИС эффективно улучшает эректильную функцию в течение всего периода лечения.
При ежедневном использовании у мужчин с ДГПЖ, пациентов нужно инструктировать принимать одну таблетку примерно в одно и то время каждый день.
Ссылки
- Переведено: http://pi.lilly.com/us/cialis-pi.pdf
Если хотите можете обратиться к врачам за помощью. В нашем каталоге лучшие специалисты:
Рейтинг препаратов для потенции
Дорогие друзья. Данный материал не является медицинским советом, за диагнозом и способом лечения, обратитесь к специалисту для консультации.